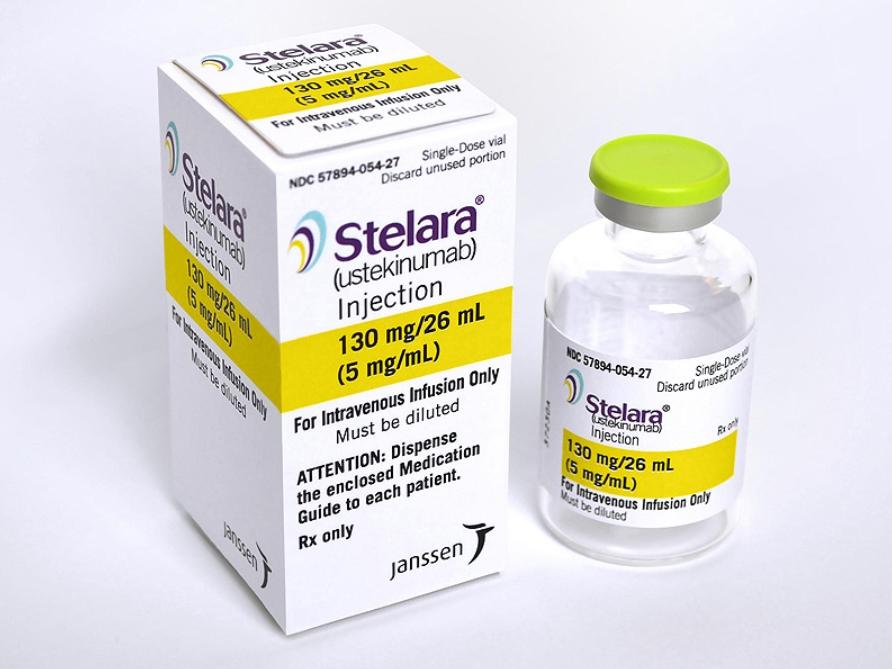
STELARA USTEKINUMAB 乌司奴单抗 优特克单抗注射剂
【商品名称】:STELARA
【通用名称】:USTEKINUMAB
【中文名称】:乌司奴单抗/优特克单抗注射剂/
Stelara(ustekinumab,乌司奴单抗,优特克单抗注射剂)说明书
【Stelara 生产企业】
Janssen Biotech(杨森制药)
【Stelara 适应症】
Stelara(ustekinumab)是一种白细胞介素(IL)-12 和 IL-23 拮抗剂(免疫抑制剂),适用于以下患者:
- 成人及6岁及以上儿童的中度至重度斑块状银屑病:适用于对其他系统性治疗或光疗(紫外线照射治疗)无效或不耐受的患者。
- 成人活动性银屑病关节炎(PsA):可单独使用或与甲氨蝶呤联用。
- 成人中重度活动性克罗恩病(CD):适用于其他药物治疗失败的患者。
- 成人中重度活动性溃疡性结肠炎(UC):适用于其他药物治疗失败的患者。
【Stelara 规格】
- 皮下注射剂型:
- 单剂量预充式注射器:45 mg/0.5 mL 或 90 mg/1 mL ustekinumab。
- 单剂量小瓶:45 mg ustekinumab。
- 静脉注射剂型:
- 单剂量小瓶:130 mg ustekinumab。
【Stelara 作用机制】
Ustekinumab 是一种人源化单克隆抗体,可特异性结合 IL-12 和 IL-23 细胞因子。IL-12 和 IL-23 在炎症信号传导中起关键作用,其异常表达与银屑病、银屑病关节炎、克罗恩病及溃疡性结肠炎的发病相关。
通过阻断 IL-12 和 IL-23 的活性,ustekinumab 可抑制炎症反应,从而缓解疾病症状。
【Stelara 批准情况】
欧洲药品管理局(EMA)批准:
- 2009年1月15日:成人斑块状银屑病。
- 2013年9月23日:成人活动性银屑病关节炎。
- 2015年6月29日:成人中重度活动性克罗恩病。
- 2016年11月11日:青少年(≥6岁)中重度斑块状银屑病。
- 2019年9月4日:成人中重度活动性溃疡性结肠炎。
- 2020年1月15日:儿童(≥6岁)中重度斑块状银屑病。
美国食品药品监督管理局(FDA)批准:
- 2009年9月25日:成人斑块状银屑病。
- 2013年9月23日:成人活动性银屑病关节炎。
- 2016年9月26日:成人中重度活动性克罗恩病。
- 2017年10月13日:青少年(≥6岁)中重度斑块状银屑病。
- 2019年10月21日:成人中重度活动性溃疡性结肠炎。
- 2020年7月30日:儿童(≥6岁)中重度斑块状银屑病。
FDA 孤儿药认定:
- 2010年11月:1型糖尿病(保留β细胞功能患者)。
- 2016年5月:儿童克罗恩病。
- 2017年2月:儿童溃疡性结肠炎。
- 2017年7月:儿童系统性红斑狼疮。
(注:其他地区可能已获批,具体请咨询当地监管机构。)
【Stelara 用法用量】
1. 斑块状银屑病:
- 体重≤100 kg:45 mg 皮下注射,初始剂量(第0周)及第4周各一次,随后每12周一次。
- 体重>100 kg:90 mg 皮下注射,初始剂量(第0周)及第4周各一次,随后每12周一次。
2. 银屑病关节炎:
- 标准剂量:45 mg 皮下注射,初始剂量(第0周)及第4周各一次,随后每12周一次。
- 合并中重度斑块状银屑病且体重>100 kg:90 mg 皮下注射,每12周一次。
3. 克罗恩病:
- 诱导治疗:按体重静脉输注(具体剂量参考处方信息)。
- 维持治疗:90 mg 皮下注射,每8周一次。
4. 溃疡性结肠炎:
- 诱导治疗:单次按体重静脉输注。
- 维持治疗:90 mg 皮下注射,每8周一次。
注意事项:
- 皮下注射可由患者或护理人员经培训后自行给药,静脉输注需在医疗机构完成。
- 治疗前需筛查结核病(TB)感染。
【Stelara 不良反应】
常见不良反应(≥3%患者):
- 头痛
- 鼻咽炎(鼻喉部炎症)
严重不良反应:
- 感染风险增加(细菌、真菌、病毒)。
- 免疫功能抑制及特定癌症风险升高。
特殊人群用药:
- 妊娠期及哺乳期安全性尚未明确,建议避免使用。
【Stelara 临床研究数据】
1. 斑块状银屑病(PHOENIX 1 & 2研究):
- PASI 75(皮损改善≥75%):
- PHOENIX 1:ustekinumab 45 mg 组67% vs 90 mg 组66% vs 安慰剂组3%(第12周)。
- PHOENIX 2:ustekinumab 45 mg 组67% vs 90 mg 组76% vs 安慰剂组4%(第12周)。
2. 银屑病关节炎(PSUMMIT I & II研究):
- ACR 20(关节炎症状改善≥20%):
- PSUMMIT I:ustekinumab 45 mg 组42% vs 90 mg 组50%(第24周)。
- PSUMMIT II:ustekinumab 45 mg 组44% vs 90 mg 组44%(第24周)。
3. 克罗恩病(UNITI-1 & 2研究):
- 临床缓解(CDAI下降≥100或总分<150):
- UNITI-1:ustekinumab 组34% vs 安慰剂组22%(第6周)。
- UNITI-2:ustekinumab 组56% vs 安慰剂组29%(第6周)。
4. 溃疡性结肠炎(UNIFI-1研究):
- 临床缓解率:
- 诱导期(第8周):ustekinumab 组19%。
- 维持期(第44周):ustekinumab 组45%。
【Stelara 常见问题解答】
1. 能否在家自行注射?
皮下注射可经培训后自行给药,静脉输注需在医疗机构进行。
2. 起效时间?
部分患者数周内改善,完全疗效可能需数月,个体差异较大。
3. 用药期间能否接种疫苗?
避免接种活疫苗,非活疫苗需咨询医生。
4. 漏用如何处理?
尽快补注并恢复原定计划,具体遵医嘱。
5. 药物相互作用?
可能与其他免疫抑制剂存在相互作用,需告知医生所有用药。
6. 储存条件?
冷藏(2°C–8°C),避光,勿冷冻或摇晃。
7. 妊娠期能否使用?
安全性未明确,建议治疗期间避孕。
8. 需监测哪些指标?
定期检查感染迹象,必要时进行实验室检测。
【温馨提示】
如需要更多Stelara(ustekinumab,乌司奴单抗,优特克单抗注射剂)资讯,欢迎与致泰药业联络查询。香港致泰药业是经香港政府卫生署注册的药品批发商,专注于全球新特药品进出口业务。

注:以上资讯来源于网络,并由致泰药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助全球各地华人患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药建议及依据, 如想要进一步了解药品,请谘询主治医师。