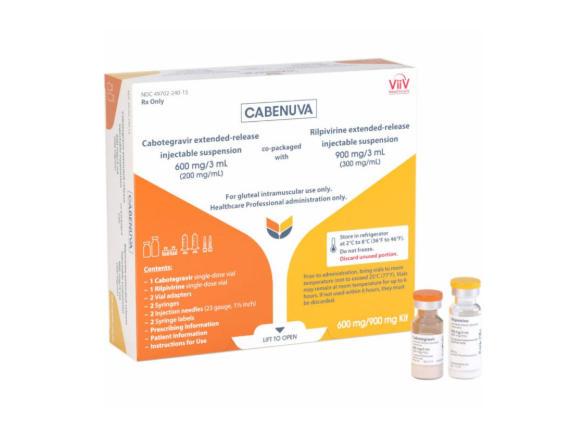
CABENUVA 卡博特韦与利匹韦林缓释注射混悬液
【商品名称】:CABENUVA
【通用名称】:CABOTEGRAVIR AND RILPIVIRINE
【中文名称】:卡博特韦与利匹韦林缓释注射混悬液
Cabenuva(cabotegravir and rilpivirine)说明书
【Cabenuva生产企业】
ViiV Healthcare
【Cabenuva适应症】
Cabenuva(cabotegravir and rilpivirine)是一种注射用、长效、完整治疗方案,适用于人类免疫缺陷病毒1型(HIV-1)感染的成人患者,每月给药一次。该药为处方药,用于治疗HIV-1感染,作为其当前HIV-1治疗的替代方案,需在医疗提供者确认患者符合特定要求时使用。
【Cabenuva规格】
该药提供卡博特韦混悬液小瓶和利匹韦林混悬液小瓶(400/600 mg 或 600/900 mg)。
【Cabenuva作用机制】
Cabenuva中的活性成分卡博特韦是一种整合酶抑制剂。它可以阻断病毒用于在体内复制的整合酶。通过阻断整合酶,卡博特韦可降低血液中的HIV病毒数量并维持低水平。
Cabenuva中的另一活性成分利匹韦林是一种非核苷类逆转录酶抑制剂。该分子可阻断病毒用于制造自身新拷贝的逆转录酶。通过阻断逆转录酶,利匹韦林可降低HIV病毒数量。
该药物无法治愈HIV感染或艾滋病,但可使免疫系统自我修复并防止进一步损害。
【Cabenuva上市许可信息】
Cabenuva(cabotegravir and rilpivirine)已获以下机构批准用于治疗HIV-1感染患者:
加拿大卫生部于2020年3月18日批准。
美国食品药品监督管理局于2021年1月21日批准。
澳大利亚治疗商品管理局于2021年2月23日批准。
该药物可能已在所列区域以外的其他地区获得批准。
【Cabenuva用法用量】
标准给药方案如下:
在开始治疗前第一个月,每日一次口服起始片剂,以评估对Cabenuva的耐受性:一片30 mg的Vocabria(卡博特韦)和一片25 mg的Edurant(利匹韦林)。
在第1个月的最后一天,给予首次注射:600 mg(3 mL)卡博特韦和900 mg(3 mL)利匹韦林。
从第3个月开始,进行持续注射:每月一次注射400 mg(2 mL)卡博特韦和600 mg(2 mL)利匹韦林。
两次注射需由医疗专业人员分别注射至两侧臀部。
Cabenuva(cabotegravir and rilpivirine)可能影响其他药物的作用方式,其他药物也可能影响该药物的作用方式,因此必须告知医生所有正在使用的药物。该药物可能在血液中存留较长时间(可达12个月或更久)。
关于Cabenuva(cabotegravir and rilpivirine)剂量(调整)和给药的完整信息,请参阅官方处方信息。
【Cabenuva不良反应】
常见不良反应
处方信息中列出的最常见副作用(≥2%的患者)包括:
注射部位反应
发热
疲劳
头痛
肌肉疼痛
恶心
睡眠障碍
头晕
皮疹
严重不良反应
处方信息中列出的严重不良反应包括:
严重注射部位反应
肝脏问题
抑郁或情绪变化
【Cabenuva在特定人群中的使用】
尚不清楚Cabenuva(cabotegravir and rilpivirine)是否会伤害胎儿。该药物可能在血液中存留较长时间(可达12个月或更久)。
患有HIV-1感染的母亲不应进行母乳喂养,因为病毒可通过母乳传播给婴儿。
【Cabenuva临床试验】
美国食品药品监督管理局批准Cabenuva(cabotegravir and rilpivirine)用于治疗成人HIV-1感染是基于ATLAS (NCT02951052) 和FLAIR (NCT02938520) 试验的数据。
ATLAS和FLAIR是两项随机、开放标签临床试验,比较了Cabenuva与抗逆转录病毒疗法在病毒学抑制的成人HIV-1感染患者中的效果。这两项研究共涉及1182名参与者:ATLAS纳入了曾尝试其他抗逆转录病毒药物的参与者,FLAIR纳入了先前未接受过治疗的参与者。参与者接受每月一次的长效Cabenuva治疗或继续每日口服抗逆转录病毒治疗。
结果
两项研究的主要疗效终点是第48周时HIV-1 RNA ≥50 copies/mL的患者比例。
结果显示,Cabenuva与继续每日口服方案同样有效。
在ATLAS试验中,接受Cabenuva治疗的308名参与者中有5名(1.6%),接受口服治疗的308名参与者中有3名(1.0%)出现HIV-1 RNA水平≥50 copies/mL。
在FLAIR试验中,接受Cabenuva治疗的283名参与者中有6名(2.1%),接受口服治疗的283名参与者中有7名(2.5%)出现HIV-1 RNA水平≥50 copies/mL。
【Cabenuva用药常见问题】
从当前HIV药物治疗直接转换为Cabenuva注射剂的条件
大多数患者需要在开始Cabenuva注射前服用卡博特韦和利匹韦林的口服制剂约一个月。这有助于确保在转换至注射方案前对药物有良好的耐受性。医疗提供者将指导转换过程。
错过预定Cabenuva注射预约的处理措施
应尽快联系医疗提供者重新安排预约。错过或延迟注射可能增加HIV耐药性或降低疗效的风险。若预计延迟时间较长,医疗提供者可能会开具口服药物。
使用Cabenuva期间应避免的药物或补充剂
某些药物,包括一些抗惊厥药、利福平和圣约翰草,可能会降低Cabenuva的疗效。应告知医疗提供者所有正在服用的药物、维生素和草药补充剂,以避免潜在的相互作用。
Cabenuva在合并感染乙型或丙型肝炎患者中的使用
Cabenuva对乙型肝炎病毒无活性,不能替代乙型肝炎治疗。若患者患有乙型或丙型肝炎,医疗提供者在规划HIV治疗时会考虑此情况,并可能建议额外的监测或药物治疗。
针对肾脏或肝脏问题患者的特殊考虑
Cabenuva通常不推荐用于严重肝病患者。对于轻度至中度肝功能损害或肾脏问题的患者,医疗提供者将评估风险与获益,并在治疗期间密切监测。
停止治疗后Cabenuva中的药物在体内存留时间
卡博特韦和利匹韦林在最后一次注射后可在体内存留达一年或更久。这意味着药物相互作用或副作用可能会持续存在,若停用Cabenuva,应立即开始替代的HIV治疗。
Cabenuva最常见的注射部位反应
患者常在注射部位出现疼痛、发红、肿胀或硬块。这些反应通常为轻度至中度,并在几天内消退。轮换注射部位和使用冷敷可能有助于缓解不适。
Cabenuva在儿童或青少年中的安全性或有效性
Cabenuva目前仅批准用于18岁及以上的成人。尚未确定其在儿童和青少年中的安全性和有效性。
是否可以在家接受Cabenuva注射
不可以。Cabenuva注射必须由训练有素的医疗专业人员在临床环境中进行,以确保技术正确并监测即时反应。
【温馨提示】
如需要更多Cabenuva(cabotegravir and rilpivirine,卡博特韦与利匹韦林缓释注射混悬液)资讯,欢迎与致泰药业联络查询。香港致泰药业是经香港政府卫生署注册的药品批发商,专注于全球新特药品进出口业务。

注:以上资讯来源于网络,并由致泰药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助全球各地华人患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药建议及依据, 如想要进一步了解药品,请谘询主治医师。