QFITLIA FITUSIRAN
【商品名称】:QFITLIA
【通用名称】:FITUSIRAN
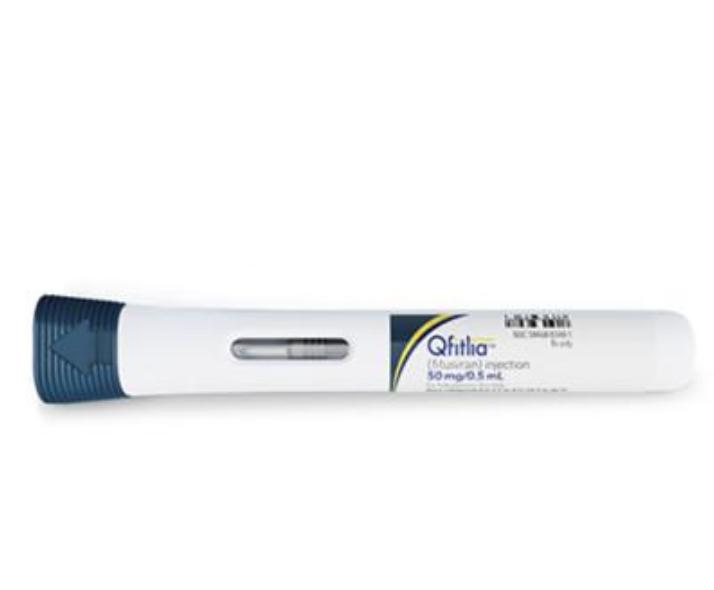
Qfitlia(fitusiran)说明书
【Qfitlia生产企业】
生产企业:赛诺菲(SANOFI)
【Qfitlia适应症】
Qfitlia(fitusiran)是一种针对抗凝血酶(AT)的小干扰核糖核酸(siRNA)药物,适用于常规预防,以预防或减少12岁及以上患有血友病A或B的成人和儿童患者的出血发作频率,无论患者是否伴有VIII或IX因子抑制物。
【Qfitlia规格】
剂型:注射剂
规格:
- 单剂量预充式注射笔:50毫克/0.5毫升(100毫克/毫升)
- 单剂量小瓶:20毫克/0.2毫升(100毫克/毫升)
【Qfitlia用法用量】
给药途径:仅供皮下注射。
推荐剂量:
- 起始剂量:每2个月一次,每次50毫克。
- 通过FDA批准的检测方法监测抗凝血酶(AT)活性,调整剂量和/或给药频率,将AT活性维持在15%-35%之间。
重要提示:
- 使用前请仔细阅读完整处方信息中的准备和给药说明。
- 肝功能监测:基线及治疗期间需定期检查肝功能(详见【警告和注意事项】)。
【Qfitlia禁忌症】
目前尚无明确禁忌症。
【Qfitlia警告和注意事项】
黑框警告
- 血栓事件
- 接受Qfitlia治疗的患者曾发生严重血栓事件,危险因素包括:
- 持续抗凝血酶(AT)活性低于15%;
- 每月一次使用80毫克Qfitlia;
- 留置静脉导管;
- 未遵循出血管理指南的术后环境。
- 处理措施:如发生血栓事件,应立即中断Qfitlia治疗,并根据临床指征进行干预。
- 接受Qfitlia治疗的患者曾发生严重血栓事件,危险因素包括:
- 急性及复发性胆囊疾病
- 部分患者出现胆囊疾病(如胆囊炎、胰腺炎),部分需行胆囊切除术。
- 监测与处理:
- 定期监测胆囊疾病相关症状(如腹痛、恶心、呕吐);
- 如发生胆囊疾病,考虑中断或停用Qfitlia;
- 对有症状性胆囊疾病病史的患者,建议选择血友病替代疗法。
其他注意事项
- 肝毒性:
- 基线及治疗前6个月需每月监测肝功能,剂量调整后需复查,此后定期检查。
- 如出现肝功能异常,可能需中断或终止治疗。
【Qfitlia不良反应】
常见不良反应(发生率>10%):
- 病毒感染
- 鼻咽炎
- 细菌感染
【Qfitlia在特殊人群中使用】
- 肝功能不全患者:
- 避免用于Child-Pugh A、B或C级肝功能不全患者。
- 儿童患者:
- 仅适用于12岁及以上青少年,安全性及有效性数据有限。
- 妊娠及哺乳期:
- 尚无充分数据,使用需权衡潜在风险与获益。
【Qfitlia药物相互作用】
目前尚未进行系统性研究,与其他抗凝药物联用可能增加出血或血栓风险,需谨慎。
【Qfitlia药理机制】
Qfitlia通过靶向降低抗凝血酶(AT)的活性,促进凝血酶生成,从而恢复血友病患者的止血平衡。
【Qfitlia储存条件】
- 未开封药品:2-8℃冷藏,避免冷冻。
- 开封后:需在指定时间内使用,具体参见包装说明。
【Qfitlia批准信息】
- FDA批准日期:2025年3月28日
【温馨提示】
如需要更多Qfitlia(fitusiran)资讯,欢迎与致泰药业联络查询。香港致泰药业是经香港政府卫生署注册的药品批发商,专注于全球新特药品进出口业务。