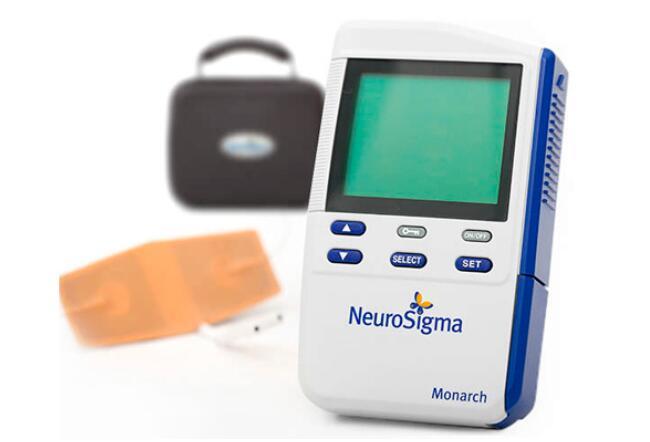
FDA批准非药物系统第二代Monarch eTNS治疗儿童多动症
在医学领域,治疗儿童注意力缺陷/多动症(ADHD)的方法一直备受关注。近日,美国食品药品监督管理局(FDA)批准了NeuroSigma的第二代Monarch外部三叉神经刺激(eTNS)系统Monarch eTNS,成为首个获得FDA认可的非药物治疗儿童多动症的技术。这一消息为儿童多动症患者带来新的希望,也在医疗领域迎来了一次创新的时刻。
目录
ADHD的挑战与争议
ADHD作为一种神经发育障碍,给7至12岁患者带来了认知参与活动中注意力不集中、活动过多、行为冲动等症状。目前,对ADHD的治疗主要包括心理咨询、生活习惯改变、行为疗法和药物。然而,对于在儿童中广泛使用兴奋剂药物的争议始终存在。在这个背景下,NeuroSigma的第二代Monarch eTNS系统获得FDA批准,为儿童多动症的治疗提供了一种新的非药物选择。
Monarch 2.0:创新治疗的新里程碑
NeuroSigma的第二代Monarch eTNS系统是一项外部三叉神经刺激技术,通过在患者前额贴片处传递低水平电脉冲,影响与ADHD相关的脑区活动。该系统的尺寸约为第一代的三分之一,包括高分辨率彩色LCD屏幕和优化的用户界面。该设备旨在在护理人员的监督下在家中使用,患者在睡眠期间佩戴至少8小时。这项创新治疗方法的推出,不仅在技术上取得了重要突破,同时也填补了儿童多动症治疗领域的一项空白。
临床验证:Monarch 2.0的效果
FDA的批准是基于一项纳入62名中度至重度多动症儿童的安慰剂对照临床试验数据。研究结果显示,使用eTNS设备治疗多动症症状在统计学上有显著改善,表现在多动症评定量表评分和临床总体印象评分上。虽然最常见的副作用包括困倦、食欲增加、睡眠障碍等,但相对于传统药物治疗,其副作用更加温和。
NeuroSigma总裁兼首席执行官Colin Kealey博士表示:“随着FDA的批准和Monarch 2.0的年中推出,我们可以开始扩大我们的商业运营规模,以帮助治疗美国和全球数百万患有多动症的儿童。”在未来,该公司计划与加州大学洛杉矶分校、西雅图儿童医院和伦敦国王学院等学术合作伙伴展开多中心双盲试验,旨在进一步验证eTNS在治疗多动症中的作用。这一创新治疗方法的商业采用和支付者覆盖范围有望在不久的将来迎来更大的发展。
NeuroSigma表示,他们正在致力于开发治疗广泛神经和精神疾病的疗法,包括多动症、耐药性癫痫、自闭症谱系障碍(ASD)和抑郁症。Monarch 2.0的成功批准不仅对儿童多动症患者而言是一次福音,也为未来神经科学治疗领域的创新带来了更多期待。随着技术的不断进步,我们有望见证更多科技创新在医学领域取得突破,为患者提供更加个性化和温和的治疗选择。

注:以上资讯来源于网络,并由致泰药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助全球各地华人患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药建议及依据, 如想要进一步了解药品,请咨询主治医师。