28
8月
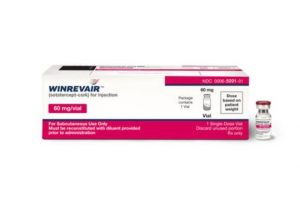
Winrevair(Sotatercept)联合治疗肺动脉高压在欧盟获批
近年来,肺动脉高压(PAH)作为一种罕见而严重的血管疾病,逐渐受到全球医学界的广泛关注。默克公司于2024年8月26日宣布,其最新研发的药物WINREVAIR (Sotatercept) 已获得欧盟委员会批准,可与其他疗法联合用于治疗功能分级为II至III级的PAH成人患者。这一突破为众多患者带来了新的治疗选择和希望。 肺动脉高压的严峻挑战 肺动脉高压是一种进展性、危及生命的疾病,其特征在于小肺动脉的逐渐收缩,导致肺循环血压升高。这种病症的危险在于它会给心脏带来巨大压力,导致心脏负荷过重,并最终可能引发心力衰竭。患者常常表现出严重的呼吸困难、运动耐受性下降等症状,生活质量大幅度降低。根据REV... 查看详情
28
8月
IMCIVREE用于2岁幼儿患者肥胖症治疗获FDA优先审查
肥胖症在儿童中的治疗一直是医学上的一大挑战。近日,Rhythm制药公司宣布,美国食品药品监督管理局(FDA)已接受其关于IMCIVREE(setmelanotide,司美诺肽)的补充新药申请,并给予优先审查。这一申请的核心是IMCIVREE治疗由Bardet-Biedl综合征(BBS)或阿片黑素促皮质激素原(POMC)缺陷引起的肥胖症,特别是那些年仅2岁的患儿。FDA计划在2024年12月26日之前做出审查决定,给这一迫切需要的治疗手段带来了希望。 IMCIVREE的作用机制:靶向基因缺陷的突破性治疗 IMCIVREE的独特性在于其作用机制,它通过激活黑皮质素-4受体(MC4R),直接针对由于... 查看详情
27
8月
FDA授予opaganib(Yeliva,ABC294640)神经母细胞瘤孤儿药资格认定
在医学领域的不断探索中,新的药物和治疗方法不断涌现,为患者带来了希望。其中,Opaganib(Yeliva,ABC294640)作为一种新型药物,正逐渐引起人们的关注。近日,美国食品药品监督管理局(FDA)授予 Opaganib 孤儿药称号,用于治疗神经母细胞瘤患者。这一消息为神经母细胞瘤的治疗带来了新的曙光。 一、神经母细胞瘤的危害与现状 神经母细胞瘤是一种严重的疾病,它由未成熟的神经细胞发展而来,是儿童最常见的颅外实体肿瘤,约占儿童癌症相关死亡的 15%。这种疾病通常影响 5 岁或以下的儿童,但也可能发生在年龄较大的儿童身上。在美国,每年大约有 650 例新的神经母细胞瘤病例被诊断出来。目... 查看详情
27
8月
欧盟批准Ordspono(odronextamab)用于滤泡性淋巴瘤和弥漫性大B细胞淋巴瘤
在医学不断进步的今天,欧洲药品管理局的一项重要决策为众多淋巴瘤患者带来了新的曙光。Ordspono(odronextamab)获得批准,用于治疗复发 / 难治性滤泡性淋巴瘤(FL)或弥漫性大 B 细胞淋巴瘤(DLBCL)的成年患者,这些患者需接受过至少两种系统性治疗。 一、临床试验成果显著 ELM-2 试验中的卓越表现 在 ELM-2 试验中,128 名复发 / 难治性 FL 患者经独立评审委员会评估,总体缓解率(ORR)高达 80%,其中完全缓解(CR)率为 73%。对于达到完全缓解的患者,中位缓解持续时间(DOR)为 25 个月(95% 置信区间,20 – 不可评估 [NE])... 查看详情
27
8月
SteQeyma作为Stelara(乌司奴单抗)的生物仿制药在欧盟获批
2024 年 8 月 25 日,Celltrion 宣布其研发的 SteQeyma®(CT-P43)获得了欧盟委员会(EC)的批准。 一、SteQeyma® 的性质与适用范围 SteQeyma® 是乌司奴单抗注射液的生物仿制药,其前身 Stelara® 可用于治疗多种慢性炎症性疾病。SteQeyma® 被批准作为生物制剂,适用于胃肠道、皮肤病学和风湿病学等领域。 二、批准依据 EC 对 SteQeyma® 的批准是基于全面的证据。其中包括针对中度至重度斑块型银屑病成人的 3 期研究结果,主要终点是银屑病面积和皮肤症状严重指数(PASI)的百分比变化。研究表明,SteQeyma® 与其前身 St... 查看详情
26
8月
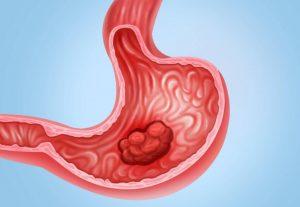
Vyloy(Zolbetuximab,佐妥昔单抗)治疗CLDN18.2阳性胃癌在英国获批
近日,英国药品和保健品管理局(MHRA)的一项批准决定,安斯泰来制药公司的 Vyloy(zolbetuximab,佐妥昔单抗 )被批准作为部分胃癌患者一线联合治疗的一部分,这一消息无疑为那些与病魔抗争的患者带来了曙光。 一、Vyloy 的批准背景与意义 在英国,胃癌是一种严重威胁人们健康的疾病。腺癌作为胃癌中最常见的一种类型,由胃最内层细胞发展而来。每年约有 6,600 人被诊断出患有腺癌,这个数字背后是无数家庭的担忧与痛苦。大多数胃癌病例直到晚期才被发现,原因在于该疾病在早期很少引起明显症状,并且往往会在数年内缓慢发展。这使得患者在确诊时,病情常常已经较为严重,治疗难度也大大增加。 Vylo... 查看详情
24
8月
厄达替尼(Erdafitinib,Balversa)获得欧盟批准用于治疗FGFR3阳性不可切除的转移性尿路上皮癌
厄达替尼Erdafitinib(商品名Balversa)已获得欧盟委员会的批准,用于治疗那些携带FGFR3基因变异的不可切除或转移性尿路上皮癌患者。这些患者之前至少接受过一线含有PD-1或PD-L1抑制剂的转移性治疗。 厄达替尼Erdafitinib在THOR研究中展现显著疗效 厄达替尼Erdafitinib的批准基于III期THOR研究的队列1数据,该研究表明厄达替尼Erdafitinib相较于化疗能显著降低36%的死亡风险。厄达替尼Erdafitinib治疗组的中位总体生存期(OS)为12.1个月,而化疗组为7.8个月。 无进展生存期和响应率的显著提升 厄达替尼Erdafitinib治疗的... 查看详情
23
8月
恩诺单抗(Padcev)加帕博利珠单抗在加拿大获批用于晚期膀胱癌
膀胱癌,尤其是转移性尿路上皮癌,一直以来都是严重威胁人类健康的疾病。其具有侵袭性强、治疗选择有限以及预后不良等特点,给患者及其家庭带来了沉重的负担。然而,近日加拿大卫生部(Health Canada)的一项批准决定,为这一困境带来了重大转机。 一、重大批准,开启新篇 加拿大卫生部批准了恩诺单抗(enfortumab vedotin,Padcev)与帕博利珠单抗(pembrolizumab,Keytruda)的联合用药方案,用于治疗未接受过转移性疾病系统治疗的成人不可切除局部晚期或转移性尿路上皮癌患者。这一决定为广大患者带来了新的希望,标志着膀胱癌治疗领域迈出了重要的一步。 二、数据支撑,疗效显... 查看详情
23
8月
Leqembi(仑卡奈单抗)治疗阿尔茨海默病在英国获批
2024 年 08 月 22 日,一则振奋人心的消息从东京和马萨诸塞州剑桥传来,卫材株式会社和 Biogen Inc. 共同宣布,人源化淀粉样蛋白 -β(Aβ)单克隆抗体 Leqembi®(lecanemab,仑卡奈单抗)获得了英国药品和保健品管理局(MHRA)的营销授权。这一重大突破为阿尔茨海默病(AD)的治疗带来了新的希望,也标志着首个针对早期 AD 潜在病因的治疗药物在欧洲国家获批。 一、Leqembi 的适用人群及重要意义 Lecanemab 适用于治疗载脂蛋白 E ε4(ApoE ε4)杂合子或非携带者的成年患者的轻度认知障碍(MCI)和 AD 导致的轻度痴呆。在英国,估计有 982... 查看详情
22
8月
乐伐替尼(Lenvima,Lenvatinib)标签更新:纳入晚期非透明细胞肾癌一线疗效
近日,口服多靶点酪氨酸激酶抑制剂Lenvatinib(商品名:Lenvima)的标签更新,加入了该药物在一线治疗晚期非透明细胞肾癌(nccRCC)中的疗效数据。此次标签更新基于KEYNOTE-B61(NCT04704219)II期临床试验的结果,该试验评估了乐伐替尼(Lenvima)与Pembrolizumab(Keytruda)联合用药治疗晚期nccRCC患者的效果。 尽管如此,乐伐替尼(Lenvima)与Keytruda联合用于晚期肾癌患者一线治疗的批准适应症并未发生变化。 乐伐替尼(Lenvima)与Keytruda:抗肿瘤效果的验证 据纪念斯隆凯特琳癌症中心的医学肿瘤学家Martin ... 查看详情