25
12月
NICE对Rezurock(Belumosudil)治疗慢性移植物抗宿主病给予积极评价
在迈向医疗科技不断进步的道路上,新的治疗方案的出现为患者带来了新的曙光。近期,国家健康与护理卓越研究所(NICE)对Rezurock(Belumosudil)在慢性移植物抗宿主病(cGVHD)治疗中的积极意见,为患者提供了一项创新的治疗选择。本文将深入探讨Rezurock(Belumosudil)的重要性以及NICE的评价,为读者解读这一里程碑性的进展。 Rezurock(Belumosudil)的背景 Rezurock(Belumosudil)是一种治疗慢性移植物抗宿主病的新疗法,适用于12岁及以上的患者,这是英格兰和威尔士首个可用于已接受至少2线系统治疗的患者的疗法。该药物于2021年7月... 查看详情
24
12月
欧盟批准Rezzayo(Rezafungin)用于治疗侵袭性念珠菌病
近日,Mundipharma公司宣布令医学领域备受瞩目的消息:Rezzayo(Acetate Rezafungin)醋酸瑞扎芬净已成功获得欧盟(EU)的批准,将作为一项创新的治疗手段用于成人侵袭性念珠菌病。这一决定是在欧盟委员会(EC)积极审批后做出的,该审批基于人用药品委员会(CMUH)对ReSTORE III期临床试验的肯定意见。该试验结果表明,瑞扎芬净(Rezafungin)以每周一次的频率给药,其统计非劣效性超越了目前的护理标准卡泊芬净(Caspofungin)每天一次的给药方式。此外,这一决定也得到了II期STRIVE临床试验的积极结果和广泛非临床开发计划的全面支持。 治疗侵袭性念珠... 查看详情
23
12月
FDA优先审议Patritumab Deruxtecan在EGFR阳性NSCLC患者的治疗申请
肺癌是全球癌症发病率和死亡率的主要原因之一,而EGFR突变型非小细胞肺癌(NSCLC)患者的治疗一直备受关注。近期,美国食品和药物管理局(FDA)接受并优先审议了一项生物制剂许可申请(BLA),该申请旨在获得HER3-定向抗体药物复合物Patritumab Deruxtecan在成年患者中作为局部晚期或转移性EGFR突变型NSCLC的一线治疗的批准。 HERTHENA-Lung01试验结果支持优先审议 这一决策得到了来自HERTHENA-Lung01试验的数据支持。该试验包括先前接受至少两种系统治疗的EGFR激活突变的局部晚期或转移性NSCLC患者。试验结果显示,Patritumab Deru... 查看详情
23
12月
FDA考虑将amivantamab+Lazertinib一线治疗EGFR阳性非小细胞肺癌
在癌症治疗领域,靶向治疗一直是一个备受瞩目的领域,尤其是对于EGFR突变的非小细胞肺癌患者。最近,Amivantamab-vmjw(Rybrevant)与Lazertinib(Leclaza)的联合治疗方案在一项重大的三期MARIPOSA研究中展现出了显著的疗效,引起了FDA的高度关注。 新治疗方案的背景 EGFR突变在非小细胞肺癌中相当常见,因此寻找更有效的治疗手段一直是医学研究的重要目标。Amivantamab与Lazertinib的联合治疗方案即将成为一线治疗的新选择。这一方案的申请已经提交给FDA,期待成为EGFR突变非小细胞肺癌患者的新希望。 MARIPOSA研究的关键数据 MARI... 查看详情
22
12月
FDA已接受因子XIIa抑制剂Garadacimab用于遗传性血管性水肿的预防的生物制剂许可申请
2023年12月14日,CSL宣布其因子XIIa抑制剂Garadacimab的生物制剂许可申请(BLA)获得美国FDA接受,并已提交至欧洲药品管理局(EMA)。Garadacimab标志着新一代的遗传性血管性水肿(HAE)预防性治疗药物的崭新篇章。此药的革新性不仅在于其成为美欧首个针对活化因子XII(FXIIa)的HAE治疗手段,更得益于其在VANGUARD试验中取得的显著疗效。 关于Garadacimab Garadacimab是一种重组单克隆抗体,其设计目的在于抑制活化的因子XIIa。这一激肽释放酶-激肽级联的血浆蛋白在HAE攻击中扮演关键角色。在CSL的努力下,Garadacimab成为... 查看详情
22
12月
FDA批准Wainua(Eplontersen)治疗转甲状腺素淀粉样变性多发性神经病
2023年12月21日,美国FDA正式批准Wainua®(eplontersen)用于治疗成人遗传性转甲状腺素蛋白介导的淀粉样变性的多发性神经病(ATTRv-PN)。这标志着Wainua®不仅是首个通过每月1次自行注射的自动注射器给药的ATTRv-PN治疗药物,更是为数不多的通过反义寡核苷酸(ASO)疗法取得成功的先驱之一。 Wainua®的突破之处 Wainua®背后的强大背书来自阿斯利康(AstraZeneca)和Ionis Pharmaceuticals两大医药领军企业。这款治疗ATTRv-PN的药物采用反义寡核苷酸(ASO)技术,可由患者每月一次自行皮下注射。这也是ASO疗法首次在AT... 查看详情
22
12月
FDA全面批准TARPEYO(布地奈德缓释胶囊)治疗原发性免疫球蛋白肾病(IgA肾病)
在全球范围内,肾脏疾病问题日益突出,其中原发性免疫球蛋白 A 肾病(IgA肾病)作为一种潜在危害肾功能的自身免疫性疾病备受关注。近日,Calliditas Therapeutics AB宣布,其布地奈德缓释胶囊(TARPEYO®)已获得美国食品和药物管理局(FDA)全面批准,成为治疗IgA肾病的新里程碑。 TARPEYO®背后的科学力量 TARPEYO®的核心成分是布地奈德,这是一种B细胞免疫调节剂。它通过独特的机制,针对IgA肾病的病源,有助于减少导致该病的致病性半乳糖缺陷型IgA1抗体的产生。这一创新科学力量的结合,使TARPEYO®成为治疗IgA肾病的前沿药物。 NefIgArd临床试验... 查看详情
21
12月
替尔泊肽Mounjaro(Tirzepatide)是否比Ozempic更适合减肥?
随着生活方式和饮食结构的变化,肥胖问题在全球范围内不断上升,而寻找安全有效的减重药物成为医学领域的一个挑战。替尔泊肽Mounjaro(Tirzepatide)®和Ozempic™是两种备受关注的药物,既能治疗2型糖尿病,又被寄予厚望在减重中发挥积极作用。 Mounjaro®的崭新面貌 自2017年被美国食品和药物管理局(FDA)批准以来,Mounjaro®(tirzepatide)凭借其在减重方面的成功而受到媒体的广泛关注。作为2型糖尿病药物,Mounjaro®通过抑制食欲帮助人们更快感到饱足。在寻找有效减重药物的人中,Ozempic™备受推崇。 Mounjaro®的工作原理 Mounjaro... 查看详情
21
12月
FDA批准Padeliporfin VTP用于不可切除胰腺癌的新药申请
在FDA批准调查Padeliporfin血管靶向光动力学治疗不可切除胰腺癌的新药申请后,一项阶段1研究即将展开。 解读FDA批准:探索Padeliporfin VTP的前景 美国食品和药物管理局(FDA)已批准Padeliporfin血管靶向光动力学(VTP)的新药申请,为一项阶段1临床试验铺平了道路。Padeliporfin VTP是一种微创肿瘤治疗平台,具有手术一样的疗效,并能保护健康组织或器官。 这项试验将重点评估该药物在不可切除的胰腺导管腺癌(PDAC)患者中的应用,旨在满足局部晚期胰腺癌的未满足需求。该新药申请的批准标志着FDA对Padeliporfin VTP进行的临床研究即将展开... 查看详情
21
12月
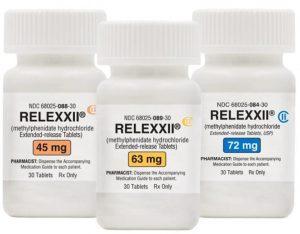
盐酸哌甲酯缓释片Relexxii治疗注意力缺陷多动障碍(多动症)在美国上市
2023年12月19日,位于佐治亚州阿尔法利塔的Vertical Pharmaceuticals, LLC的母公司Alora Pharmaceuticals, LLC正式宣布,Relexxii®(盐酸哌甲酯缓释片)已成功上市。这一消息意味着在注意力缺陷多动障碍(ADHD)治疗领域迎来了一款创新性的治疗选择。 Relexxii的生物等效性研究 1.1 创新性研究背后的科学支持 Relexxii的上市得益于对60名健康志愿者进行的一项研究,该研究发现每日一次服用72mg的Relexxii与每日两次服用Concerta®(盐酸哌甲酯)36mg片剂在生物等效性上具有相当水平。这一研究结果为Relexx... 查看详情