10
1月
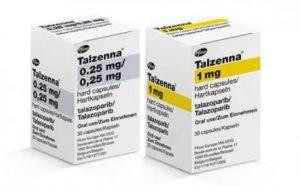
Talzenma(他拉唑帕利)+恩杂鲁胺治疗转移性去势抵抗性前列腺癌在欧盟获批
近日,辉瑞公司宣布其口服多聚ADP核糖聚合酶(PARP)抑制剂TALZENNA(他拉唑帕利,talazoparib)与XTANDI(恩杂鲁胺,enzalutamide)联用,成功获得欧盟委员会(EC)的批准,用于治疗临床上不适合化疗的转移性去势抵抗性前列腺癌(mCRPC)成年患者。这一突破性的治疗方案为欧洲地区的患者提供了新的希望,标志着PARP抑制剂在前列腺癌领域的重要里程碑。 TALZENNA与XTANDI联合治疗mCRPC获得欧盟批准 1. 治疗适应症的拓展 TALZENNA是第一个在欧盟获得许可的PARP抑制剂,通过与XTANDI联合使用,用于治疗患有或不患有基因突变的mCRPC患者。... 查看详情
06
1月
FDA的批准Zelsuvmi(Berdazimer)10.3%外用凝胶治疗传染性软疣
随着科技的不断发展,药物研发领域迎来了许多创新性的治疗方案。Ligand Pharmaceuticals 近日宣布,其领先的“first-in-class”药物 Zelsuvmi(Berdazimer,10.3%)外用凝胶已经获得美国FDA的批准,用于治疗成人和1岁及以上儿童传染性软疣(软疣)。这一成果将为感染性皮肤感染的患者提供一种全新的治疗选择。 B-SIMPLE 试验证实 Zelsuvmi 的疗效 3期临床研究 Zelsuvmi 的疗效在两项关键的3期试验(B-SIMPLE4 和 B-SIMPLE2)中得到了充分验证。B-SIMPLE4 试验中,研究人员评估了 Berdazimer 治疗... 查看详情
05
1月
基因疗法Beqvez治疗18岁或以上B型血友病在加拿大获批
在基因疗法领域的最新进展中,辉瑞公司的Beqvez(fidanacogene elaparvovec)在加拿大获得卫生部批准,成为治疗18岁或以上B型血友病的一项突破性治疗手段。这一消息为血友病患者带来了新的曙光,标志着基因疗法在医学领域的崭新里程碑。 Beqvez基因疗法获准治疗B型血友病 2024年01月03日,辉瑞公司宣布其基因疗法Beqvez已经获得加拿大卫生部的批准,用于治疗18岁或以上中重度至重度B型血友病成人患者。这是一项受到高度关注的决定,将为B型血友病患者提供更为便捷和创新的治疗选择。 临床试验成果 Beqvez的批准主要基于其在BENEGENE-2临床3期试验中的表现。该研... 查看详情
05
1月
重症肌无力新药Zilbrysq(zilucoplan)在美国上市
重症肌无力(gMG)是一种罕见而严重的免疫系统性疾病,患者可能面临全身肌肉无力和疲劳。近日,全球生物制药公司优时比(UCB)带来了一个令人振奋的消息,其创新药物Zilbrysq(zilucoplan)已成功在美国上市。这款药物的到来标志着科学家们在gMG治疗领域迈出了重要的一步,为患者提供了更便捷且有效的治疗方式。 1. Zilbrysq背后的创新技术 Zilbrysq是一种自我给药的C5补体抑制剂,成为美国食品药品监督管理局(FDA)批准的第一个、也是唯一一个自我给药的C5补体抑制剂,用于治疗抗乙酰胆碱受体(AChR)抗体阳性的成年患者的全身性重症肌无力(gMG)。这一创新技术的引入为gMG... 查看详情
05
1月
口服疗法Mitapivat或将为非输血依赖性地中海贫血带来新的曙光
地中海贫血,一种遗传性小细胞性溶血性贫血,常导致贫血、虚弱和疲乏等症状。而非输血依赖性地中海贫血则是一类无需常规输血或仅在特殊情况下需要输血的地贫类型。迄今为止,尚未有FDA批准的非输血依赖型地中海贫血的口服疗法。然而,最新研究表明,Agios Pharmaceuticals公司的Mitapivat或将成为该领域的先驱。 1. Mitapivat在非输血依赖性地中海贫血的突破性研究 最近,Agios Pharmaceuticals公司发布了Mitapivat在全球范围内进行的3期ENERGIZE研究的重大突破,该研究覆盖了非输血依赖性α-或β-地中海贫血成人。这一研究取得了令人振奋的成果,为M... 查看详情
04
1月
FDA授予DOC1021治疗恶性神经胶质瘤的孤儿药资格
医学领域的不断创新推动着癌症治疗的进步,而在这不懈的努力中,DOC1021作为治疗恶性胶质瘤的细胞疗法迈出了关键的一步。美国食品药品监督管理局(FDA)授予DOC1021孤儿药品认定,为其在恶性胶质瘤领域的疗效打开了更为广阔的可能性。本文将深入分析DOC1021的独特之处、研究结果以及未来前景,展现这一细胞疗法给恶性胶质瘤患者带来的新希望。 DOC1021的独特之处 DOC1021是一种独特的疫苗,由患者的树突状细胞和其肿瘤样本制成。通过使用树突状细胞,可以在不对患者免疫细胞进行基因修饰的情况下,精准地针对完整的癌症抗原。此外,这种疫苗利用了自然的免疫反应,可以像对待病毒感染一样,针对并清除癌... 查看详情
04
1月
新一代鼻咽癌药物Loqtorzi在美国推出
随着医学研究和药物研发的不断进步,鼻咽癌患者有望迎来新的治疗时代。最新批准上市的药物Loqtorzi(toripalimab-tpzi,特瑞普利单抗)在美国上市,为成人转移性或复发性局部晚期鼻咽癌(NPC)的治疗提供了新的选择。 Loqtorzi的作用机制 Loqtorzi是一种程序性死亡受体-1(PD-1)单克隆抗体,具有针对鼻咽癌的独特作用机制。它通过调节免疫系统的活性,对抗癌细胞,为患者提供了一种全新的治疗途径。 临床试验结果 Loqtorzi的批准基于两项关键临床试验的结果:JUPITER-02试验和POLARIS-02研究。在JUPITER-02研究中,Loqtorzi与化疗联合使用... 查看详情
03
1月
FDA将审查Rybrevant(amivantamab-vmjw)用于NSCLC亚群的潜在批准申请
近日,强生公司(Johnson & Johnson)向美国食品和药物管理局(FDA)提交了关于Rybrevant(amivantamab-vmjw)和lazertinib联合应用的两个独立申请,旨在争取其在EGFR基因exon 19缺失或L858R替代突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者中的一线治疗获批。这一新疗法的前景令人瞩目,有望填补目前EGFR突变NSCLC患者治疗领域的不足。 试验结果支持 强生公司通过一份新闻稿宣布,他们已向FDA提交了一份补充生物制品许可申请和一份新药申请,以推动Rybrevant和lazertinib的联合应用获批。这一决定得到了MARIP... 查看详情
03
1月
FDA授予Aglatimagene Besadenovec+Valacyclovir治疗胰腺癌的快速通道地位
胰腺癌是一种具有高度侵袭性和低预后的癌症类型,迄今为止,对于这一疾病的治疗仍然是一项巨大的挑战。然而,一项新的临床研究带来了令人振奋的消息:美国食品和药物管理局(FDA)已授予Aglatimagene Besadenovec联合Valacyclovir用于胰腺导管腺癌(PDAC)的快速通道地位。这一决定标志着一种全新的治疗策略正在迅速推进,为胰腺癌患者带来了新的希望。 Aglatimagene Besadenovec及其机制 Aglatimagene Besadenovec(CAN-2409)是一种腺病毒复制缺陷的工程基因构造,其中包含了单纯疱疹病毒(HSV)衍生的胸腺嘧啶激酶基因。这种离体疗... 查看详情
03
1月
Arimoclomol针对C型尼曼匹克病的新药申请重新向美国FDA提交
2023年12月22日,Zevra Therapeutics,一家致力于罕见病治疗的公司,为其对抗尼曼匹克病C型(NPC)的使命取得了重要的里程碑。该公司自豪地宣布已经再次向美国食品和药物管理局(FDA)提交了Arimoclomol的新药申请(NDA)。这一研究中的治疗候选药物对于解决这种罕见而致命的神经系统疾病的未满足医学需求具有巨大的潜力。随着制药界急切期待FDA的回应,Zevra致力于推进患者护理的决心依然坚定不移。 I. Arimoclomol NDA再次提交:勤奋工作的胜利 Zevra Therapeutics表达了为Arimoclomol的NDA再次提交提供全面和高质量工作的坚定承... 查看详情