27
3月
艾加莫德α(VYVDURA)治疗原发免疫性血小板减少症在日本获批
2024年3月26日,再鼎医药合作伙伴argenx公司宣布,日本厚生劳动省已批准艾加莫德静脉输注剂型((VYVDURA))用于治疗原发免疫性血小板减少症(ITP)成人患者。这一消息标志着该治疗方案在日本市场上的正式推出,为患有这一罕见疾病的患者带来了新的希望和选择。 临床研究结果展示优势 艾加莫德α在日本获批的决定是建立在全球3期临床研究ADVANCE-IV的基础之上的。这项研究结果于2023年9月刊登在《柳叶刀》杂志上,证实了艾加莫德在治疗慢性ITP患者中的显著疗效。与安慰剂相比,接受艾加莫德治疗的患者获得了更高比例的血小板计数持续应答,显示出了治疗的有效性和可靠性。此外,艾加莫德治疗慢性I... 查看详情
26
3月
欧盟批准Ryzneuta(艾贝格司亭α)用于治疗化疗引起的中性粒细胞减少症
在医学的持续创新与发展中,治疗癌症的手段也在不断演进。然而,与化疗相关的副作用,尤其是化疗引起的中性粒细胞减少症(Chemotherapy-Induced Neutropenia,简称CIN),一直是医学界和患者所面临的重要挑战之一。CIN不仅会影响患者的生活质量,还可能导致治疗方案的中断和剂量的调整,进而影响治疗效果。然而,现在,一种创新的生物药物——Ryzneuta,正为应对这一挑战而出现,其在欧盟的批准上市将为更多患者带来希望和新的治疗选择。 Ryzneuta的背景与获批情况 2024年3月24日,亿帆医药宣布其子公司自主研发的创新生物药Ryzneuta(通用名:艾贝格司亭α注射液,F-... 查看详情
25
3月
FDA批准PEMGARDA(Pemivibart)暴露前预防新冠病毒感染
2024年3月22日,生物制药公司Invivyd, Inc.宣布了一项重要的突破,他们的产品PEMGARDA™ (pemivibart)获得了美国食品和药物管理局(FDA)的紧急使用授权(EUA)。PEMGARDA™是一种半衰期延长的单克隆抗体(mAb),用于成人和青少年的COVID-19(新冠病毒感染)暴露前预防(PrEP)。 疫苗接种与免疫反应受损 疫苗接种一直被认为是控制COVID-19传播的主要手段之一,然而,多种医疗状况或治疗可能会导致免疫系统受损,从而降低对疫苗的免疫反应。这些情况包括血液系统恶性肿瘤(血癌)或接受实体器官或干细胞移植后的免疫抑制治疗。观察性研究表明,即使接种了疫苗... 查看详情
24
3月
FDA批准Opsynvi(马昔腾坦/他达拉非)用于治疗肺动脉高压
肺动脉高压(PAH)是一种罕见但严重的血管疾病,它对患者的生活质量和预期寿命造成了严重威胁。随着科学技术的进步,针对这一病症的治疗方案也在不断创新和完善。在这个领域,强生(Johnson & Johnson)公司的最新药物Opsynvi的获得FDA批准,为PAH患者带来了新的希望和选择。 Opsynvi获批治疗肺动脉高压 2024年3月22日,美国FDA正式批准了强生公司开发的Opsynvi单片剂组合疗法,该疗法含有马昔腾坦和他达拉非,用于治疗严重的PAH成人患者。这一新药的获批意味着,在PAH治疗领域又迈出了重要一步,为患者提供了更有效的治疗选择。 关键临床研究结果 Opsynvi的... 查看详情
24
3月
FDA批准NEXLETOL和NEXLIZET用于预防心脏病发作和心血管手术
2024年3月22日,Esperion公司宣布美国食品和药物管理局(FDA)已批准NEXLETOL®(bempedoic acid)片剂和NEXLIZET®(bempedoic acid和ezetimibe)基于CLEAR Outcomes积极数据的片剂,标志着一项重要的突破。这一决定意味着NEXLETOL和NEXLIZET成为预防心脏病发作和心血管手术的可靠选择。 清除心血管风险的重要一步 NEXLIZET和NEXLETOL的获批对于心血管健康领域具有重大意义。这两种药物的批准基于CLEAR Outcomes试验的积极数据,该试验是对近14,000名心血管病患者进行的。数据显示,这些药物不仅... 查看详情
23
3月
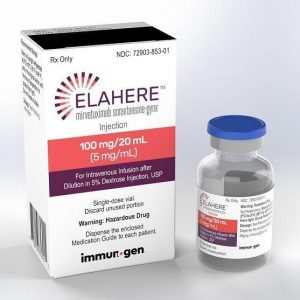
FDA全面批准Elahere(Mirvetuximab Soravtansine)治疗FRα阳性铂类耐药性卵巢癌
卵巢癌是一种在女性中相当常见的癌症类型,其中一部分患者出现了对铂类药物的耐药性,给治疗带来了极大的挑战。然而,随着医学科技的不断发展,美国食品药品监督管理局(FDA)最近批准了一项新的治疗方法,为一些既往接受过治疗的患者带来了新的希望。 Elahere对于FRα阳性铂类耐药性卵巢癌的全面批准 近日,FDA正式批准了Elahere(mirvetuximab soravtansine-gynx)用于特定的铂类耐药性卵巢癌患者。这一决定为曾接受过治疗的FRα阳性、铂类耐药性的上皮性卵巢癌、输卵管癌或原发性腹膜癌患者开辟了新的治疗途径。 MIRASOL研究:关键数据支持决定 这一决定的依据来自于MIR... 查看详情
22
3月
Lifileucel(Amtagvi)的获批标志着黑色素瘤治疗的转折点
随着美国食品药品监督管理局(FDA)批准细胞疗法Lifileucel(LN-44;Amtagvi)用于黑色素瘤的治疗,我们目睹了黑色素瘤治疗领域的一个重要转折点。这一突破性的治疗方法不仅为患者带来了希望,而且展示了令人振奋的抗肿瘤活性,其潜力还延伸到各种实体肿瘤。然而,尽管Lifileucel的出现给我们带来了新的曙光,但仍然存在着一些挑战。 Lifileucel:黑色素瘤治疗的新希望 最近美国食品药品监督管理局(FDA)批准了Lifileucel(LN-44;Amtagvi),这标志着黑色素瘤患者治疗的一个重大进步,特别是对于那些处于晚期阶段的患者,因为它提供了一种新颖的个体化治疗方法。 L... 查看详情
22
3月
FDA批准氟尿嘧啶安全标签更新:关于DPD缺乏症患者的使用
在医学领域,安全标签的更新通常是为了确保药物的使用更加安全和有效。最近,美国食品药品监督管理局(FDA)批准了氟尿嘧啶产品的安全标签更新,其中包括有关在具有二氢嘧啶脱氢酶(DPD)缺陷患者中使用该药物的信息。这一决定对于临床实践和患者的安全具有重要意义。 DPD缺陷与氟尿嘧啶 氟尿嘧啶注射剂产品的安全标签更新包括有关与二氢嘧啶脱氢酶(DPD)缺陷患者严重不良反应(AEs)风险的额外信息。DPD由DPYD基因编码,是对氟尿嘧啶的破坏代谢负责的酶之一。部分DPD缺陷在白人患者中约占3%至5%,完全DPD缺陷约占0.2%。然而,非白人人群中DPD缺陷的比例尚无足够数据可供估计。已知与DPD活性受损相... 查看详情
22
3月
FDA批准Duvyzat(Givinostat)治疗六岁及以上杜氏肌营养不良患者
2024年3月21日,美国FDA批准了由Italfarmaco研发的Duvyzat(givinostat)口服药物,用于治疗六岁及以上的杜氏肌营养不良(DMD)患者。这一消息在医学界掀起了轩然大波,因为Duvyzat是首个获批用于治疗携带任何DMD基因变异患者的非类固醇口服疗法。这个突破意味着DMD患者有了更多治疗选择,也为这个罕见病提供了新的希望。 临床试验与疗效验证 Duvyzat(givinostat)的批准基于一项随机双盲、安慰剂对照、多中心3期临床试验的积极结果。该试验招募了179名平均年龄为9岁的具有行走能力的男性患者,这些患者已稳定接受类固醇治疗至少6个月。试验采用2:1的比例,... 查看详情
22
3月
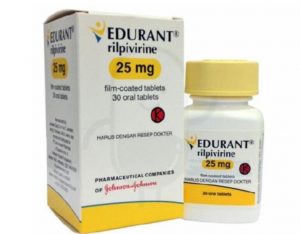
FDA批准利匹韦林(rilpivirine,EdurantPED)治疗初治HIV-1儿童
近年来,随着医学技术的不断进步,人类对于艾滋病毒(HIV)的治疗取得了重大突破。2024年3月19日,美国食品和药物管理局(FDA)宣布批准了EdurantPED(rilpivirine,利匹韦林)与其他抗逆转录病毒疗法联合使用,用于治疗HIV-1感染的初治儿童。这一消息无疑为儿童艾滋病患者及其家庭带来了新的希望和机遇。 利匹韦林的应用及研究结果 利匹韦林是一种人类免疫缺陷病毒1型(HIV-1)特异性非核苷逆转录酶抑制剂(NNRTI),其与其他抗逆转录病毒药物联合使用,已被证明对HIV-1感染的初治患者具有显著疗效。根据FDA的批准,利匹韦林可以用于治疗年满2岁且体重至少14公斤且低于25公斤... 查看详情