EMA批准Trodelvy治疗预处理HR+/HER2-转移性乳腺癌
吉利德科学公司宣布,欧洲药品管理局(EMA)已批准Trodelvy(sacituzumab govitecan-hziy)的II型变异上市许可申请(MAA),用于治疗不可切除或转移性激素受体(HR)阳性,人表皮生长因子受体2(HER2)阴性(IHC 0,IHC 1+或IHC 2 + / ISH-)乳腺癌成年患者,这些乳腺癌已接受基于内分泌的治疗和至少两种额外的转移性全身治疗。
“在吉利德肿瘤学,我们的目标是改变对癌症患者的护理,”吉利德肿瘤学高级副总裁兼治疗领域负责人BillGrossman博士说。“Trodelvy已经在推动我们实现这一雄心壮志,并改变整个欧盟二线转移性三阴性乳腺癌的护理标准。我们在预处理的HR+/HER2-转移性乳腺癌中的上市许可申请的批准标志着向可能使Trodelvy可用于更多治疗选择严重有限的患者迈出了重要一步。
本上市许可申请基于注册3期TROPiCS-02研究的数据,该研究满足其主要终点无进展生存期(PFS)和总生存期(OS)的关键次要终点与对照化疗(医生选择的治疗(TPC))相比。PFS数据发表在《临床肿瘤学杂志》上,OS数据最近在2022年ESMO大会上发表。
以上图片为Trodelvy(sacituzumab govitecan)在致泰药业实拍图
TROPiCS-02中Trodelvy的安全性与先前的研究一致,并且在该人群中未发现新的安全信号。
2022年10月,美国食品药品监督管理局(FDA)接受Trodelvy的补充生物制品许可证申请(sBLA)进行优先审查,该申请用于治疗不可切除的局部晚期或转移性HR+/HER2阴性(IHC0、IHC1+或IHC2+/ISH–)乳腺癌成年患者,这些患者已接受内分泌治疗和至少两种额外的全身治疗在转移情况下。处方药使用者费用法案(PDUFA)的目标行动日期目前定为2023年2月。
Trodelvy尚未被任何监管机构批准用于治疗HR+/HER2-转移性乳腺癌。其安全性和有效性尚未确定用于该适应症。
以上图片为Trodelvy(sacituzumab govitecan)在致泰药业实拍图
激素受体阳性/人表皮生长因子受体2阴性(HR+/HER2-)乳腺癌是最常见的乳腺癌类型,约占所有新病例的70%,即全球每年近400,000例诊断。几乎三分之一的早期乳腺癌最终会转移,在HR+/HER2-转移性疾病患者中,五年相对生存率为30%。随着HR+/HER2-转移性乳腺癌患者对基于内分泌的治疗产生耐药性,他们的主要治疗选择仅限于单药化疗。在这种情况下,在治疗过程中接受多线化疗方案是很常见的,并且预后仍然很差。
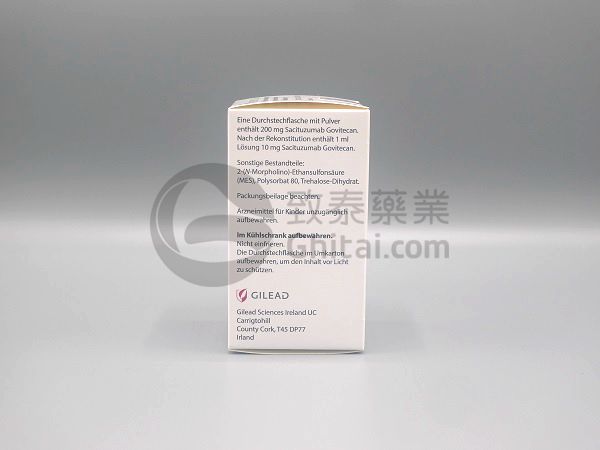
以上图片为Trodelvy(sacituzumab govitecan)在致泰药业实拍图
TROPiCS-02研究是一项全球性、多中心、开放标签的3期研究,随机1:1评估Trodelvy与医生选择的化疗(艾日布林、卡培他滨、吉西他滨或长春瑞滨)在543名HR+/HER2- met患者中既往接受过内分泌治疗、CDK4/6抑制剂和两到四线化疗治疗转移性疾病的无静态乳腺癌。主要终点是实体瘤反应评估标准(RECIST 1.1)的无进展生存期,通过盲法独立中心评价(BICR)评估,与接受化疗的受试者相比,接受Trodelvy治疗的受试者。次要终点包括总生存期、总缓解率、临床获益率和缓解持续时间,以及安全性和耐受性以及生活质量指标的评估。在这项研究中,根据美国临床肿瘤学会(ASCO)和美国病理学家学会(CAP)标准,HER2阴性定义为免疫组织化学(IHC)评分为0,IHC 1+或IHC 2+,原位杂交(ISH)测试阴性。

以上图片为Trodelvy(sacituzumab govitecan)在致泰药业实拍图
Trodelvy(sacituzumab govitecan-hziy)是同类首创的Trop-2定向抗体-药物偶联物。Trop-2是一种细胞表面抗原,在多种肿瘤类型中高度表达,包括超过90%的乳腺癌和膀胱癌。Trodelvy特意设计了专有的水解接头,连接到SN-38,一种拓扑异构酶I抑制剂有效载荷。这种独特的组合为表达Trop-2的细胞和微环境提供有效的活性。
Trodelvy已在40多个国家获得批准,全球正在进行多项额外的监管审查,用于治疗既往接受过两种或两种以上全身治疗的不可切除的局部晚期或转移性三阴性乳腺癌(TNBC)成年患者,其中至少一种用于转移性疾病。Trodelvy还在美国根据加速批准途径获得批准,用于治疗既往接受过含铂化疗和程序性死亡受体-1(PD-1)或程序性死亡配体1(PD-L1)抑制剂的局部晚期或转移性尿路上皮癌(UC)成年患者。
Trodelvy也正在开发用于其他TNBC和转移性UC人群的潜在研究用途,以及Trop-2高度表达的一系列肿瘤类型,包括HR+/HER2-转移性乳腺癌,转移性非小细胞肺癌(NSCLC),转移性小细胞肺癌(SCLC),头颈癌和子宫内膜癌。
Trodelvy哪里有卖?如何购买正版Trodelvy(Sacituzumab govitecan-hziy)?
香港致泰药业代理供应Trodelvy(Sacituzumab govitecan-hziy)。香港致泰药业是经香港政府卫生署注册的药品批发商,超过30年香港药房运营经验,与全球各大制药厂建立起良好的合作关系,专注于全球新特药品进出口业务,Trodelvy(Sacituzumab govitecan-hziy)最新价格欢迎与致泰药业联络查询。


