12
2月
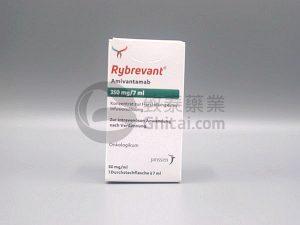
欧洲药品管理局审查埃万妥单抗Rybrevant联合Leclaza治疗EGFR+非小细胞肺癌
在肺癌治疗领域,特异性靶向药物的研发和应用已经取得了巨大的进展。EGFR突变型非小细胞肺癌(NSCLC)的治疗策略中,EGFR酪氨酸激酶抑制剂已经成为一线治疗的主要选择。最新的研究表明,埃万妥单抗Rybrevant(Amivantamab)与Leclaza(Lazertinib)的联合应用可能成为一种颠覆性的治疗方式。欧洲药品管理局(EMA)正在审查一项关于该联合疗法的扩展适应症申请,以将其纳入EGFR突变型NSCLC的一线治疗方案。 关键研究结果 MARIPOSA研究结果:通过MARIPOSA研究(NCT04487080)的数据显示,在对429名患者进行22个月中位随访后,接受埃万妥单抗Ry... 查看详情
11
2月
FDA授予Soquelitinib治疗T细胞淋巴瘤的孤儿药资格
淋巴瘤是一种涉及淋巴系统的癌症,其中T细胞淋巴瘤是其中一种类型。针对T细胞淋巴瘤的治疗一直是医学界关注的焦点之一,然而,目前尚未有许多有效的治疗方法。近期,美国食品药品监督管理局(FDA)授予了Soquelitinib(前身为CPI-818)孤儿药物认定,将其作为潜在的T细胞淋巴瘤治疗选项。这一消息由Corvus Pharmaceuticals, Inc.宣布。 Soquelitinib的作用机制与临床研究 Soquelitinib是一种口服的、研究中的小分子药物,旨在选择性抑制在T细胞中表达的白细胞介素-2诱导性T细胞激酶(ITK)。ITK在T细胞和自然杀伤细胞免疫功能中发挥作用。 一项在2... 查看详情
10
2月
RGX-121治疗II型粘多糖病(MPS II)的关键性试验达到主要终点
近年来,基因治疗技术的突破为罕见疾病的治疗带来了新的希望。在这个领域,REGENXBIO Inc.一直致力于开发创新的治疗方法,以改善患者的生活质量。最近,他们的一项重要研究取得了重大进展,为罕见的II型粘多糖病(MPS II,亦称亨特综合征)的治疗提供了新的希望。这一突破性的研究成果将为临床实践和患者福祉带来革命性的影响。 突破性进展 REGENXBIO Inc.近日宣布了他们针对MPS II治疗的关键性临床试验RGX-121的顶线结果。这项名为CAMPSIITE的试验针对5岁以下被诊断为MPS II的患者展开,结果显示,该试验的关键阶段达到了主要终点,且具有统计学意义。这一重要里程碑的实现... 查看详情
08
2月
FDA授予Vepdegestrant(ARV-471)用于ER+/HER2-转移性乳腺癌的快速通道地位
近日,美国食品药品监督管理局(FDA)已将Vepdegestrant(ARV-471)授予了快速通道地位,用于ER阳性/HER2阴性的局部晚期或转移性乳腺癌的成人患者,这些患者之前接受过内分泌为基础的治疗。这种口服可生物利用的PROTAC蛋白降解剂旨在针对和降解ER以在这一人群中使用。临床前数据表明,该单药疗法导致癌细胞中ER的降解率高达97%,并在多个ER驱动的异种移植模型中引起了明显的肿瘤缩小。此外,与标准的富马酸酮(Faslodex)相比,Vepdegestrant与或不与CDK4/6抑制剂联合使用也被发现可提高抗肿瘤活性。 研究背景及目的 针对胃癌或胃食管结合部腺癌的二线治疗的挑战,近... 查看详情
07
2月
加拿大卫生部将审查Ojjaara(momelotinib,莫洛替尼)治疗骨髓纤维化的新药申请
近日,GlaxoSmithKline公司宣布,加拿大卫生部将对Ojjaara(momelotinib,莫洛替尼)在髓纤维化患者中的新药申请进行审查。这一消息为那些髓纤维化患者带来了希望,也标志着医学领域对于这一治疗新方向的重视。 Ojjaara(momelotinib,莫洛替尼)在SIMPLIFY-1试验中的效果 SIMPLIFY-1试验包括了之前接受JAK抑制剂治疗的髓纤维化患者(n = 432)。他们在为期24周的时间里每日一次口服Ojjaara(momelotinib,莫洛替尼),或每天两次口服调整剂量的Ruxolitinib(Jakafi)。接受Ruxolitinib治疗的患者可以交叉... 查看详情
07
2月
FDA授予BNT325/DB-1305治疗铂耐药卵巢癌的快速通道资格
在医学科技不断进步的时代,FDA近日对BNT325/DB-1305的快速通道授予成为了医学界的一大利好消息。这标志着下一代TROP2导向的抗体药物复合物在治疗铂类耐药性卵巢癌上迈出了重要的一步。本文将深入研究这一新药的背景、临床前景以及其在填补医学需求上的潜在贡献。 BNT325/DB-1305:背景与FDA的认可 BNT325/DB-1305是一种下一代TROP2导向的抗体药物复合物(ADC),针对的是那些对铂类治疗产生耐药性的卵巢癌患者。FDA的快速通道地位基于正在进行的1/2期试验(NCT05438329)的初步数据,这些数据在2023年ESMO大会上进行了介绍。初步数据表明,在23名T... 查看详情
06
2月
大脑保健补充剂BrainPromise™在美国上市
近日,EyePromise公司宣布其全新大脑保健补充剂产品——BrainPromise正式进入美国市场。这款产品专为大脑健康、性能和保护而设计,提供全面的大脑营养,包括必需的维生素和矿物质,以及抗氧化剂、玉米黄质和叶黄素等成分。随着大量已发表的研究支持,这些成分被认为能够有效对抗氧化应激,带来诸多益处。 BrainPromise的独特之处 EyePromise公司推出的BrainPromise是一款全新的大脑保健补充剂,通过其独特的配方为用户提供全方位的大脑支持。其中包含的玉米黄质和叶黄素等成分被证明具有保护组织免受氧化应激的作用,同时也为大脑带来了长期的健康、优越的功能以及对记忆力的改善。这... 查看详情
06
2月
FDA授予不可切除/转移性间皮瘤UV1癌症疫苗快速通道指定
近日,Ultimovacs宣布其UV1癌症疫苗在与ipilimumab(Yervoy)和nivolumab(Opdivo)联合治疗不可切除的恶性胸膜间皮瘤患者方面获得了美国食品和药物管理局(FDA)的快速通道设计ation。这一决定是基于NIPU试验(NCT04300244)的数据支持的,该数据在2023年欧洲临床肿瘤学会议上进行了展示。 快速通道设计ation的背后 FDA授予UV1癌症疫苗与ipilimumab和nivolumab联合使用的快速通道设计ation,标志着这一治疗方案在不可切除的恶性胸膜间皮瘤患者中可能具有重要的疗效。该决定的依据是来自NIPU试验的数据,该试验结果表明,UV... 查看详情
06
2月
EMA接受再生元制药公司多发性骨髓瘤新疗法Linvoseltamab上市申请
多发性骨髓瘤(MM)是一种恶性肿瘤疾病,对患者的生命造成潜在威胁。再生元制药公司近期宣布,欧洲药品管理局(EMA)已接受其新型双特异性抗体疗法Linvoseltamab的上市申请,该疗法旨在治疗复发或难治性多发性骨髓瘤患者。本文将深入分析该疗法的研究背景、机制和临床试验结果,以期为读者提供对这一新疗法的全面了解。 多发性骨髓瘤背景 多发性骨髓瘤是由骨髓内恶性浆细胞异常增生引起的一种严重疾病,其特征是癌性浆细胞增殖并挤出健康血细胞,导致潜在的危及生命的器官损伤。尽管目前治疗手段不断进步,但多发性骨髓瘤仍然无法被完全治愈,许多患者最终会经历疾病的进展,需要更多的治疗。 Linvoseltamab的... 查看详情
06
2月
美曲普汀MYALEPTA治疗12岁及以上脂肪营养不良相关瘦素缺乏并发症在加拿大获批
近日,MYALEPTA™(metreleptin for injection注射用美曲普汀)已获得加拿大卫生部批准,成为治疗12岁及以上脂肪营养不良相关瘦素缺乏并发症的新型替代疗法。这一突破性疗法为先天性或获得性全身性脂肪营养不良(LD)患者提供了新的治疗选择。 MYALEPTA的适用范围 MYALEPTA作为一种重组人瘦素类似物,通过重组DNA技术在大肠杆菌细胞中生产,以产生重组人N-甲硫基肽素。该药物的适用范围包括治疗脂肪营养不良(LD)患者的瘦素缺乏并发症,具体适用于: 先天性或获得性全身性 LD患者: Berardinelli-Seip 综合征(先天性) 劳伦斯综合征(获得性) 家族性... 查看详情