19
10月
Columvi(glofitamab)用于治疗晚期淋巴瘤获美国NICE推荐
淋巴瘤是一组与淋巴系统相关的癌症,其中弥漫性大B细胞淋巴瘤(DLBCL)是最常见的亚型之一。每年,数千名英国居民被诊断患有DLBCL,这一罕见疾病的典型症状包括无痛性肿胀、盗汗、发烧和体重减轻。当前,未经治疗的DLBCL通常使用R-CHOP疗法,但该治疗仅对50-70%的患者有效。然而,最近的突破性药物,Columvi(glofitamab),为DLBCL患者带来了新的希望,该药已被美国国家健康和护理卓越研究所(NICE)推荐作为新的治疗选择。 DLBCL:一种挑战性的癌症 弥漫性大B细胞淋巴瘤是一种罕见而复杂的癌症。它可以在任何年龄发生,但多数患者在65岁或更老时才被诊断出。其症状可能不明显... 查看详情
19
10月
ADCETRIS(维布妥昔单抗)联合AVD获欧盟批准治疗霍奇金淋巴瘤
2023年10月18日,武田(Takeda)宣布欧盟委员会(EC)已批准ADCETRIS®(维布妥昔单抗,brentuximab vedotin)与阿霉素、长春花碱和达卡巴嗪(AVD)联合使用,用于治疗既往未经治疗的CD30+III期霍奇金淋巴瘤成年患者。 霍奇金淋巴瘤是一种恶性淋巴系统疾病,而CD30是其特定标志物。ADCETRIS®是一种靶向CD30的抗体药物偶联物(ADC),通过释放微管破坏剂单甲基auristatin E(MMAE)来对抗肿瘤细胞,利用Seagen的专有技术,这一突破性疗法将为患者带来新希望。 一、前所未有的治疗选择: 在此之前,ADCETRIS®已经被批准用于治疗欧洲... 查看详情
19
10月
FDA批准Bimzelx(bimekizumab-bkzx)治疗中度至重度银屑病
2023年10月18日,全球生物制药公司UCB宣布,美国食品和药物管理局(FDA)已批准Bimzelx(bimekizumab-bkzx)用于治疗中度至重度银屑病的成年患者,这些患者适合接受系统治疗或光疗。Bimekizumab是首个并且唯一批准用于选择性抑制两种主要细胞因子——白细胞介素17A(IL-17A)和白细胞介素17F(IL-17F)的治疗银屑病药物。Bimekizumab的批准得到了三个阶段3、多中心、随机对照试验(BE READY、BE VIVID和BE SURE)的数据支持,这些试验评估了1480名中度至重度银屑病成年患者的疗效和安全性。 一、创新的里程碑: UCB美国免疫解决... 查看详情
18
10月
创新树突状细胞疫苗DOC1021获得FDA快速通道指定用于胶质母细胞瘤
在现代医学研究中,充满希望的突破不断涌现,为治疗罕见而致命的疾病提供新的解决方案。2023年10月17日,Diakonos Oncology Corporation(以下简称Diakonos),一家处于临床阶段的免疫肿瘤学公司,宣布其独特的树突状细胞疫苗DOC1021已获得美国食品和药物管理局(FDA)的快速通道(Fast Track)指定,用于治疗胶质母细胞瘤(GBM)。这一决定基于来自一项针对GBM患者的I期临床试验的初步安全性和有效性数据。 DOC1021:突破性的免疫治疗方法 DOC1021代表了对抗癌症的一种全新方法,它充分利用了人体天然的抗病毒免疫反应。通过模拟病人的癌症标志物来模... 查看详情
18
10月
FDA批准XPHOZAH(Tenapanor)用于降低慢性肾病成人患者的血清磷水平
在现代医疗科学的持续推动下,新的药物和治疗方法不断涌现,为各种疾病提供了新的希望和解决方案。在这一领域,2023年10月17日,Ardelyx, Inc. 宣布XPHOZAH®(tenapanor)已获得美国食品和药物管理局(FDA)的批准,作为一项附加治疗,用于降低接受肾透析治疗的慢性肾病(CKD)成人患者的血清磷水平。这一重大的批准标志着医学领域对于肾脏疾病治疗的新突破,为CKD患者带来新的希望。 XPHOZAH:磷酸盐吸收抑制剂的创新 XPHOZAH(tenapanor)在日本商品名为PHOZEVEL®,是第一个也是唯一的磷酸盐吸收抑制剂,旨在降低患有慢性肾病(CKD)的成人透析患者的血... 查看详情
18
10月
FDA批准ZILBRYSQ(Zilucoplan)用于治疗成人全身性重症肌无力(gMG)
全身性重症肌无力(gMG)是一种自身免疫性疾病,患者可能面临肌肉无力、视觉问题、吞咽困难和呼吸肌无力等多种严重症状。在这个背景下,2023年10月17日,生物制药公司UCB宣布,他们的药物ZILBRYSQ(zilucoplan)已经获得了美国食品和药物管理局(FDA)的批准,用于治疗gMG患者中抗乙酰胆碱受体(AChR)抗体阳性的成年患者。这一批准标志着一项新的治疗选择,可能对gMG患者的生活产生积极的影响。 ZILBRYSQ:首个自行给药的gMG治疗药物 ZILBRYSQ是一种C5抑制剂,是唯一每日1次皮下注射的gMG靶向疗法,适用于抗AChR抗体阳性的gMG成年患者。这一批准使ZILBRY... 查看详情
18
10月
2型糖尿病数字行为疗法AspyreRx(BT-001)已上市
近年来,糖尿病已成为全球范围内的重大健康挑战,特别是2型糖尿病(T2D),其影响范围和危害性逐渐扩大。然而,随着医疗科技的不断创新,我们正迈向更智能、个性化的糖尿病管理方法。在这个背景下,Better Therapeutics,Inc.于2023年宣布推出了AspyreRx(前称为BT-001) – 这是一项引人瞩目的数字行为疗法,是美国食品药品监督管理局(FDA)首次批准的认知行为疗法(CBT)应用程序,旨在帮助治疗成年2型糖尿病患者。本文将探讨AspyreRx的关键特点、疗效以及对2型糖尿病管理的潜在影响。 AspyreRx:数字行为疗法的崭新尝试 AspyreRx是一项独特的... 查看详情
17
10月
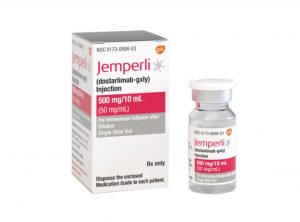
欧洲CHMP推荐多塔利单抗(Jemperli)联合化疗治疗局部晚期、复发性子宫内膜癌
子宫内膜癌是一种妇女常见的癌症,特别是在晚期和复发性病例中,治疗变得更加具有挑战性。欧洲药品管理局的人用药品委员会(CHMP)建议批准dostallimab-gxly(Jemperli)加化疗治疗患有错配修复缺陷(dMMR)/微卫星不稳定性-高(MSI-H)原发性晚期或复发性子宫内膜癌成人患者,这些患者是系统治疗的候选对象。 RUBY试验的突破性结果 CHMP的这一推荐基于了RUBY试验(NCT03981796)的研究结果,这一试验结果于2023年3月在ESMO Virtual Plenary和SGO年会上同时发表在《新英格兰医学杂志》上。研究的中期分析数据表明,接受Dostarlimab联合... 查看详情
17
10月
新发现的机制表明药物组合可能会”饿死”胰腺癌
胰腺癌,尤其是胰腺导管腺癌(PDAC),一直以来都是一种难以治疗的癌症,病情恶化迅猛,对现有治疗方式的抵抗力极强。然而,最新的研究带来了新希望,揭示了一种潜在的治疗机制,通过组合不同的药物,有望抑制胰腺癌的生长。这项研究由纽约大学格罗斯曼医学院、放射肿瘤学系和珀尔马特癌症中心的研究人员领导,基于他们先前在纽约大学朗格一院的发现,这些发现揭示了胰腺癌细胞为了避免饥饿并保持生长,如何寻找替代的能源。通常情况下,由血液供应的氧气、血糖和其他资源会因快速增长的胰腺肿瘤密度的增加而变得稀缺,这些肿瘤切断了它们自己的供血。在这种环境下,切换燃料的能力加剧了胰腺癌的致命性。 揭示的新机制 这项... 查看详情
17
10月
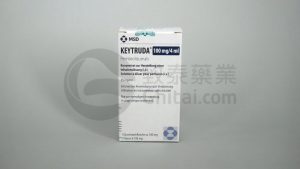
Keytruda(帕博利珠单抗)用于术后辅助治疗非小细胞肺癌在美欧获批治疗
肺癌,作为全球最常见的癌症之一,一直以来都是医学界的重要挑战。特别是非小细胞肺癌(NSCLC),它占据了肺癌病例的大多数。对于可切除的NSCLC患者,手术后的辅助治疗一直备受关注,而今,Keytruda(帕博利珠单抗)的获批,为这些患者带来了新的曙光。本文将深入探讨Keytruda在治疗NSCLC中的重要角色以及最新临床试验的令人振奋数据。 关于Keytruda Keytruda,也称为pembrolizumab,是一种人源化的抗PD-1单克隆抗体,具有阻断PD-1与其配体PD-L1、PD-L2的结合能力。这一机制激活了T淋巴细胞,加强了免疫系统对肿瘤细胞的识别和攻击。自2014年首次获得FD... 查看详情