11
10月
Bezuclastinib/Sunitinib联合治疗缓解胃肠道间质瘤的未满足需求
对于胃肠道间质瘤(GIST)患者,治疗肿瘤细胞的突变是一项具有挑战性的任务。目前,临床上广泛使用的药物包括一线治疗的伊马替尼(格列卫),二线治疗的舒尼替尼(索坦),三线治疗的雷格瑞非尼(斯帝瓦格),以及四线治疗的利普雷替尼(奎尼洛克)。然而,尽管有多种治疗选择,但约50%的患者在使用伊马替尼治疗2年后会出现耐药。由于活化的KIT突变最常见于瘤体的exon 9或11,而伊马替尼耐药通常与ATP结合区的exon 13/14或激活环exon 17/18的额外突变有关,因此需要药物来同时作用于多个突变。 在接受采访时,德克萨斯大学MD安德森癌症中心的肉瘤医学临床科学部副主任Neeta Somaiah博... 查看详情
11
10月
BXCL701与帕博利珠单抗联合治疗在SCNC mCRPC患者中取得积极总生存期数据
肿瘤治疗领域的突破性研究不断为癌症患者带来新的希望。最近的一项临床研究发现,BXCL701与帕博利珠单抗Pembrolizumab(Keytruda)联合治疗在小细胞神经内分泌前列腺癌(SCNC mCRPC)患者中表现出显著的总生存期(OS)数据,这为患有这一罕见癌症类型的患者提供了新的生存机会。 带来积极的总生存期数据 根据一项2期临床试验(NCT03910660)的数据,使用BXCL701和Pembrolizumab的联合治疗,对于患有小细胞神经内分泌前列腺癌(SCNC)的转移性去势抵抗前列腺癌(mCRPC)患者,取得了中位总生存期(OS)为13.6个月的显著结果,数据显示12个月的OS率... 查看详情
11
10月
FDA批准FoundationOne CDx作为Selpercatinib在RET+实体瘤中的伴随诊断工具
美国食品和药物管理局(FDA)已经批准了FoundationOne CDx,将其作为selpercatinib的伴随诊断工具,FDA此前批准了selpercatinib用于治疗晚期或转移性实体瘤中携带RET基因融合的成年患者,这些患者的疾病在之前的系统治疗后进展,或者没有其他满意的治疗选择。 基因诊断技术在肿瘤治疗中正发挥着越来越重要的作用。FDA最近批准了FoundationOne CDx作为selpercatinib的伴随诊断工具,这将为肿瘤患者提供更加精确的治疗方案。这一决定标志着基因医学领域的巨大进步,为患有RET基因融合的实体瘤患者提供了希望。 基因诊断工具的重要性 Foundati... 查看详情
11
10月
慢性淋巴细胞白血病新药对比研究:阿卡替尼/奥滨尤妥珠单抗疗法相对于泽布替尼的PFS优势
慢性淋巴细胞白血病(CLL)和小淋巴细胞白血病(SLL)是两种严重的血液癌症,对患者的生活质量和寿命造成了巨大影响。近年来,针对这些疾病的治疗方式有了显著的进展,其中包括了一些新一代的药物。在这项名为“ELEVATE-TN”和“SEQUOIA”的研究中,科学家们对两种新型药物进行了比较:阿卡替尼(Acalabrutinib)和泽布替尼(Zanubrutinib),以寻求更好的治疗策略。这两种药物都属于BTK抑制剂,是目前FDA批准用于CLL治疗的新药。研究结果于2023年在“慢性淋巴细胞白血病国际研讨会”上发布,显示了针对不携带17p缺失的患者,阿卡替尼和奥滨尤妥珠单抗单药疗法的显著优势。本文... 查看详情
11
10月
TJ-L14B/ABL503展示晚期或转移性实体瘤的早期疗效信号
肿瘤治疗领域一直在不断探索新的疗法,以满足那些罹患晚期或转移性实体肿瘤的患者的需求。TJ-L14B/ABL503是一种PD-L1 x 4-1BB双特异性抗体,它为之前接受治疗但疾病仍在进展的患者提供了新的治疗前景。本文将深入研究TJ-L14B/ABL503的早期疗效信号,以及它如何在临床试验中显示出潜在的疗效。 早期疗效信号 根据来自一项正在进行的1期临床试验(NCT04762641)的数据,TJ-L14B/ABL503在那些曾接受过治疗但疾病仍在进展的晚期或转移性实体肿瘤患者中展现出了初步的疗效信号。迄今为止,研究人员观察到了1例完全缓解、1例部分缓解和2例未经确认的客观缓解病例。这些数据表... 查看详情
11
10月
纤维狭窄性克罗恩病药物:FDA授予AGMB-129快速通道认证
克罗恩病,一种慢性、持续性的炎性肠疾病,给数百万患者带来了长期的痛苦。对于这些患者中的近50%,纤维狭窄成了不可忽视的问题,它不仅影响生活质量,还常常需要肠道手术。然而,一项突破性的治疗选择即将面世,美国食品药品监督管理局(FDA)已授予Agomab Therapeutics NV的AGMB-129快速通道认证,用于治疗纤维狭窄性克罗恩病(FSCD),这是一项备受期待的进展。 克罗恩病:挑战与突破 克罗恩病是一种疑难杂症,它可以在任何胃肠道部位及肠道之外的器官引发炎症反应。不仅如此,近50%的患者还会面临另一病症,即纤维狭窄。这一并发症会导致肠道狭窄,最终可能需要进行肠切除手术。当前的治疗方法... 查看详情
10
10月
自我给药的新时代:Empaveli(Pegcetacoplan)注射器获FDA批准
随着医疗科技的不断进步,患者的治疗体验和生活质量正迎来一次革命性的改变。在这个新时代,美国食品药品监督管理局(FDA)的最新批准已经掀开了一个全新的篇章,Empaveli(pegcetacoplan)注射器的获准使用,为阵发性睡眠性血红蛋白尿症(PNH)患者带来了更大的便利和自主权。 PNH:一种罕见疾病的挑战 阵发性睡眠性血红蛋白尿症(PNH)是一种极为罕见的疾病,它以红细胞的过早分裂为特征,导致溶血性贫血和一系列症状,如呼吸急促等。这种疾病的罕见性使其治疗和管理变得尤为具有挑战性。幸运的是,科学家们已经开发出一系列药物来帮助缓解PNH患者的痛苦。 Empaveli的治疗突破 在2021年5... 查看详情
09
10月
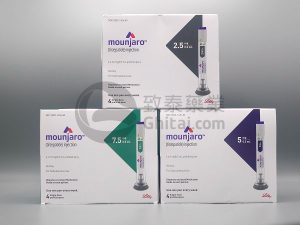
在减肥药物需求飙升的情况下,Ozempic和Mounjaro的制造商竞相增加供应
在纽约市Louis Aronne医生的减肥中心,对于Wegovy和Mounjaro等新药物的反应异常强烈。他表示:“人们把它形容为‘就像奇迹一样’,像‘这改变了我的生活’。” Louis Aronne博士是Weill Cornell Medicine的体重管理与代谢临床研究中心的主任。 需求激增,制药公司加紧生产 然而,这些被称为GLP-1受体激动剂的药物在寻求减肥的各类人士中如此受欢迎,以至于需求已经超过了制药公司的生产能力。尽管制药公司诺和挪(Novo Nordisk)以及伊莉莉(Eli Lilly)正在竞相扩大供应,但即将到来的美国食品和药物管理局(FDA)批准伊莉莉的2型糖尿病药物Mo... 查看详情
09
10月
CAPOX(卡培他滨/奥沙利铂)方案在结直肠癌中的疗效不亚于FOLFOX
随着医学领域的不断进步,癌症治疗的方式和方案也在不断演变。最近,一项名为“International Development and Education Award(IDEA)”的研究成果在2023年8月的《国家综合癌症网络杂志》上发表,引起了肠癌患者的广泛关注。这项研究涉及了一种新的治疗方法,将3个月的CAPOX(卡培他滨/奥沙利铂)辅助治疗与传统的6个月FOLFOX(氟尿嘧啶/亚叶酸/奥沙利铂)辅助治疗进行了比较。在IDEA研究之前,采用这种新的治疗方法的患者仅占14%,但在该研究之后,这一比例上升到了48%(校正的奥比斯比率[aOR]为1.28;95%置信区间[CI]为1.20-1.37... 查看详情
09
10月
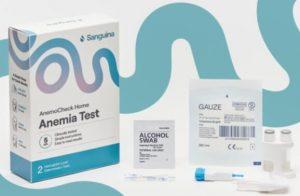
首款家用贫血监测设备AnemoCheck Home获FDA批准
贫血是一种常见的健康问题,全球有着超过19.2亿人受到其影响。特别是那些因营养不良、遗传性疾病或其他因素而患有贫血的患者,需要定期监测其血红蛋白水平,以确保及时干预和治疗。在这个背景下,美国食品药品监督管理局(FDA)近日批准了一项创新性的家用血红蛋白检测技术——AnemoCheck Home。这一设备的问世,为贫血患者提供了一种便捷、精确、可在家中使用的监测工具。 贫血是一种因体内红细胞或血红蛋白不足而引发的健康问题,影响着全球数千万人。这种疾病的种类多种多样,包括因营养缺乏引发的缺铁性贫血、维生素B12缺乏性贫血和叶酸缺乏性贫血,以及遗传性疾病如镰状细胞病和地中海贫血。无论是什么原因引发的... 查看详情