19
7月
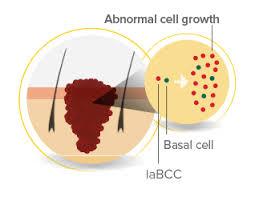
2023 年皮肤癌药物全球市场研究报告,重点关注 vismodegib (Erivedge) 和 sonidegib (Odomzo) – 2027 年和 2032 年预测
皮肤癌药物市场的主要参与者包括诺华公司、百时美施贵宝、礼来公司、Meda、太阳制药工业有限公司、罗氏公司、Aqua Pharmaceuticals、Bausch Health、葛兰素史克公司和辉瑞公司。全球皮肤癌药物市场将从 3.03 美元增长2022 年将达到10亿美元,到 2023 年将达到 34.1 亿美元,复合年增长率 (CAGR) 为 12.7%。皮肤癌药物市场预计到 2027 年将增长至52.3 亿美元,复合年增长率为 11.3%。 皮肤癌药物市场包括 vismodegib (Erivedge) 和 sonidegib (Odomzo) 的销售。该市场中的价值是“工厂门”价值,即商... 查看详情
18
7月
据 Spherix Global Insights 称,尽管市场准入障碍和熟悉度有限阻碍了最初的应用,但神经学家预计 Relyvrio 未来将广泛用于治疗 ALS
宾夕法尼亚州埃克斯顿, 2023年 3 月 9 日/美通社/ — 随着 FDA 于2022 年 9 月批准 Amylyx 的 Relyvrio(AMX0035;苯丁酸钠和牛磺二醇)治疗肌萎缩侧索硬化症 (ALS),患者只能使用第三种获批的新型分子对于这种罕见的神经退行性疾病。Mitsubishi Tanabe 的依达拉奉制剂(IV Radicava 和口服 Radicava ORS)和不同的利鲁唑制剂(仿制药、ITF Pharma 的增稠口服混悬液 Tiglutik 和 Mitsubishi Tanabe 的口腔膜剂 Exservan)是唯一获批用于 ALS 的其他疾病缓解疗法 在... 查看详情
18
7月
Amylyx 表示欧洲药品管理局可能会对 ALS 药物 Relyvrio 进行监管
Amylyx Pharmaceuticals 周二宣布,欧洲药品管理局 (EMA) 倾向于不批准 Relyvrio,这是 Amylyx Pharmaceuticals 的肌萎缩侧索硬化症 (ALS) 药物。监管机构的负面意见对 Amylyx 来说将是一个重大挫折,该公司在获得美国和加拿大的批准后,一直在推动 Relyvrio 在欧洲获得批准。 9 月,美国食品和药物管理局 (FDA)批准了 Relyvrio,但其临床益处存在争议。Amylyx 表示,这一批准是基于 CENTAUR 临床试验的结果,该试验显示在功能上有统计学上的显着益处,并且在长期分析中观察到了对生存的益处。然而,目前,EMA ... 查看详情
16
7月
医生称治疗潮热的药物将改变更年期治疗
专家预测美国批准的非唑林坦可能成为英国数千名女性的“重磅炸弹”权威医生预测,一种直接作用于大脑以预防潮热的药物将彻底改变更年期的治疗方法。在美国批准安斯泰来制药公司生产的第一种非激素更年期药物后,专家们表示,这种治疗方法可能会给英国数十万不适合激素替代药物 (HRT) 的女性带来变革。该药物名为 fezolinetant,于 5 月 12 日在美国获得许可,年底前可能在英国获批使用。伦敦帝国理工学院内分泌学家 Waljit Dhillo 教授在 2017 年领导了一项开创性试验,为该药物的开发铺平了道路。“这就像一个开关。一两天内,潮红就会消失。这些药物的功效令人难以置信。对于很多女性来说,这... 查看详情
16
7月
关于 Veozah(治疗潮热的非激素更年期药物)的知识
一种名为 Veozah 的新型更年期药物以大脑而非激素为目标,以缓解女性潮热症状。随着世界人口老龄化,预计到2030年将有12亿女性进入更年期或绝经后。在这 12 亿人中,多达 85% 的人可能会出现虚弱症状,包括潮热(也称为潮热)和盗汗,还有慢性失眠、抑郁、血栓、中风和骨质疏松症风险增加。更年期(定义为月经停止至少连续 12 个月,通常发生在 45 岁至 55 岁之间)尚未得到充分研究,部分原因是女性与男性健康研究的资金差距。 但一种新的治疗方法带来了希望。本月早些时候,美国食品和药物管理局批准了第一种非激素疗法,用于治疗更年期女性潮热的根源。Fezolinetant由 Astellas P... 查看详情
15
7月
FDA 批准的 Veozah 是否会改变更年期潮热治疗的游戏规则?
随着FDA 对 Veozah 的批准,医学界议论纷纷。这是一种独一无二的非激素药物,旨在解决更年期女性的潮热问题。它给无数一直在与这些麻烦症状作斗争的美国女性带来了新的希望。大约 80% 的更年期女性患有潮热,会突然出汗、潮红和发冷。这种令人不愉快的情况是由下丘脑温度调节中心的故障引起的,该温度调节中心由名为神经激肽 3 受体(NK3 受体)的神经元控制。雌激素通常会控制这些受体,但在更年期,雌激素水平会骤降,导致 NK3 神经元过度运转并扰乱体温。 Veozah 也称为 fezolinetant,是 FDA 批准用于治疗更年期女性中度至重度潮热的先锋非激素药物。它的工作原理是锁定大脑中这些过... 查看详情
15
7月
安斯泰来 (Astellas) 通过 Veozah 在更年期领域开辟了新天地
在获得 FDA 批准用于治疗更年期常见衰弱症状的非佐林坦 (fezolinetant) 后,安斯泰来 (Astellas) 成为首家将神经激肽 3 (NK3) 受体拮抗剂类药物推向美国市场的制药商。这种每日一次的口服药物已以 Veozah 品牌获得批准,用于治疗更年期妇女的中度至重度血管舒缩症状(通常称为潮热),成为传统雌激素替代疗法的非激素替代疗法。激素替代疗法 (HRT) 对于治疗潮热非常有效,但不建议某些女性使用,例如,如果她们患中风或心脏病或患有某些癌症的风险较高。这是因为它会增加血栓的风险或刺激某些癌症类型的生长。高达 80% 的女性在更年期的某个时期报告过 VMS,这是她们在这一阶... 查看详情
14
7月
这种新的更年期药物可以治疗潮热且副作用最小
对于数百万更年期女性来说,潮热会导致失眠、扰乱工作日,甚至会增加患心脏病和其他疾病的风险。激素替代疗法(HRT)是缓解更年期症状的标准治疗方法,但并不是每个人都可以或愿意服用激素。现在,一种新的非激素疗法即将上市。美国食品和药物管理局 (FDA) 上周批准了一种新药,可以减少更年期引起的血管舒缩症状的强度和频率,包括潮热和盗汗。这种药物称为Veozah(fezolinetant),是第一种针对大脑中调节体温的化学物质的药物。现有的非激素治疗选择包括抗焦虑和抗抑郁药物,这些药物可能会产生破坏性副作用。制药商安斯泰来表示,这种新型每日口服药丸副作用很少,乳腺癌幸存者和其他无法接受激素疗法的人可以安... 查看详情
14
7月
Fezolinetant 的 3b 期试验显示治疗更年期 VMS 的积极结果
东京, 2023 年 6 月 27 日/美通社/ — 安斯泰来制药公司(东京证券交易所代码:4503,总裁兼首席执行官:冈村直树,“安斯泰来”)今天宣布了fezolinetant 的3b期 DAYLIGHT 临床试验的积极结果正在研究用于治疗更年期引起的中度至重度血管舒缩症状 (VMS) 的非激素化合物。VMS 的特征是潮热和/或盗汗,是更年期的常见症状。 该研究由超过 450 名被认为不适合激素治疗的女性组成,达到了主要目标,显示与安慰剂相比,24 周时,每天一次 45 mg 的非佐林坦中度至重度 VMS 的频率较基线显着降低,具有统计学意义。不到 5% 的患者发生严重治疗紧急不... 查看详情
13
7月
当癌症药物试验取得 100% 的成功率时,您想知道谁是幕后黑手
2000 年代末,小路易斯·迪亚兹 (Luis Diaz Jr. ) 永远不会预料到他最终会成为本世纪免疫疗法突破之一的先锋。“我并不关心免疫疗法,”他承认。当时,他是一名肿瘤学家,为约翰·霍普金斯大学从事液体活检以早期检测癌症的开创性工作。他说,听说免疫疗法(激活患者自身的免疫系统杀死癌细胞)对黑色素瘤和肾癌有效,“并不奇怪”。“这些是免疫原性肿瘤——免疫系统喜欢吃掉它们。” 但当免疫疗法缩小肺癌肿瘤时,引起了他的注意。“对肺癌没有任何作用,”他说。 迪亚兹认为免疫疗法对肺癌有效,因为这是一种有大量突变的癌症。免疫疗法中激活的免疫细胞能够将这些突变识别为外来威胁并产生强烈的反应。但迪亚兹和他... 查看详情