13
7月
在化疗中添加 Jemperli 可延长早期子宫内膜癌的进展时间
根据一项 3 期试验的结果,在卡铂/紫杉醇中添加 Jemperli (dostarlimab-gxly) 可改善原发性晚期或复发性子宫内膜癌患者的生存并维持生活质量。3 期 ENGOT-EN6/GOG3031/RUBY 试验的结果在 2023 年美国临床肿瘤学会会议上报告。治疗三年后,接受联合治疗的患者与接受卡铂/紫杉醇加安慰剂的患者报告的结果相似。在基线、每个治疗周期的第一天和治疗结束时收集测量结果。对生活质量的几个量表进行了评估,包括全身疼痛、疲劳和身体功能。 在接受 Jemperli 加卡铂/紫杉醇治疗的错配修复缺陷(细胞具有许多突变,可能导致癌症)/微卫星不稳定性 – 高(... 查看详情
13
7月
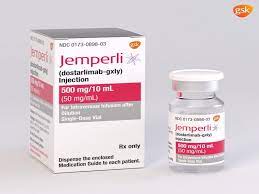
FDA 对 Dostarlimab 联合化疗治疗 dMMR/MSI-H 子宫内膜癌给予优先审查
FDA 已接受并授予优先审查补充生物制剂许可申请 (sBLA),寻求批准 dostarlimab (Jemperli) 联合化疗用于错配修复缺陷 (dMMR)/微卫星不稳定性高 (MSI-H) 成年患者原发性晚期或复发性子宫内膜癌。该申请得到了 RUBY/ENGOT-ENG/GOG3031/NSGO 3 期试验第 1 部分预先指定的中期分析结果的支持,该分析发表在《新英格兰医学杂志》上。2在该人群的中位随访时间为 24.8 个月(范围为 19.2-36.9)时,与安慰剂加化疗相比,在卡铂和紫杉醇中添加多司达利单抗可将疾病进展或死亡风险降低 72%(HR,0.28;95) % CI,0.16-0... 查看详情
13
7月
EMA 開始審查 GSK 的 Jemperli 治療子宮內膜癌
葛蘭素史克(GSK)距離批准其癌症免疫療法 Jemperli 作為歐盟子宮內膜癌的一線治療又近了一步。EMA 已開始審查 PD-1 抑製劑與化療聯合治療錯配修復缺陷 (dMMR)/微衛星不穩定性高 (MSI-H) 原發性晚期或複發性子宮內膜癌的先前未經治療的患者,並做出決定大約在今年年底或 2024 年初。該申請基於 GSK Jemperli (dostarlimab) 的RUBY試驗的第一部分,該試驗表明,與化療加安慰劑相比,經過兩年的隨訪,該組合可將疾病進展或死亡的風險降低 72%。 該公司表示,還計劃在未來幾週內向美國 FDA 提交 Jemperli 在該適應症上的營銷申請。GSK 正在... 查看详情
13
7月
Jemperli 和 Keytruda 争夺子宫内膜癌免疫治疗市场
Jemperli 已完成保险申请,Keytruda 正在准备相关文件。Keytruda 于 2021 年 12 月获得了食品药品安全部的批准,领先 Jemperli 获得了治疗 Solenoma 的适应症。卫生部批准了 Keytruda 和 Lenviama (lenvatinib) 的联合疗法,用于治疗在既往全身治疗后确诊进展且无微卫星不稳定性高 (MSI-H) 或错配修复缺陷 (dMMR) 的进展性子宫内膜癌患者。该联合疗法于 2020 年 5 月根据 KEYNOTE-146/研究 111)(一项临床试验)获得了卫生部的(不完全)批准。此外,卫生部还根据 KEYNOTE-775 的 3 期... 查看详情
13
7月
免疫療法 Jemperli 在頭半年後遇到第一個報銷障礙
葛蘭素史克的抗PD-1免疫療法Jemperli(dostarlimab)在獲得食品藥品安全部批准六個月後,已跨過報銷第一道門檻。Antengene 的一流 XPO1 抑製劑 Expovio (selinexor) 作為複發性多發性骨髓瘤的五線治療藥物可報銷,而安斯泰來的 Xtandi (恩雜魯胺) 和楊森的 Zytiga (醋酸阿比特龍) 都是前列腺癌治療藥物,患者負擔為 30% ,設置了強制覆蓋的第一個障礙。 週三,韓國健康保險審查評估院(HIRA)公佈了今年第四屆癌症疾病審查委員會的審議結果。據 HIRA 稱,Jemperli 增加了報銷標準,用於“治療接受鉑類全身化療的複發性或進行性錯配... 查看详情
13
7月
GSK 的 Jemperli 通过英国早期使用计划向子宫内膜癌患者提供
EAMS 旨在为患有危及生命或严重衰弱疾病的患者在存在明显未满足的医疗需求时提供尚未获得上市许可的药物。该组合已专门用于治疗患有错配修复缺陷(dMMR)/微卫星不稳定性高(MSI-H)原发性晚期或复发性子宫内膜癌且适合全身治疗的成人。子宫内膜癌是英国最常见的妇科癌症,每年报告约 10,000 例新病例。虽然如果早期诊断,它通常比其他子宫癌具有更好的预后,但晚期或复发性疾病的患者面临有限的治疗选择和不良的预后。 药品和保健品监管局 (MHRA) 的积极科学意见得到了 3 期 RUBY 研究第一部分的积极数据的支持,该研究评估了 Jemperli 加卡铂紫杉醇与安慰剂加卡铂紫杉醇治疗原发性晚期或复... 查看详情
13
7月
GSK 的结果揭示了 Jemperli 治疗子宫内膜癌的生存获益趋势
3月 27 日,研究人员公布了III 期 RUBY 临床试验的新中期结果,该结果可能表明子宫内膜癌治疗的新护理标准。目前子宫内膜癌的护理标准涉及卡铂和紫杉醇的联合治疗。GSK 的试验评估了程序性死亡受体 1 (PD-1) 阻断抗体 Jemperli (dostarlimab)。III 期临床试验第一部分的结果在欧洲肿瘤内科学会 (ESMO) 组织的虚拟全体会议上公布。2021年,FDA加速批准Jemperli用于治疗错配修复缺陷(dMMR)复发性或晚期子宫内膜癌成人患者,这些患者在接受含铂方案治疗时或治疗后病情进展。据GlobalData称,Jemperli是目前处于III期临床试验的11种子... 查看详情
12
7月
保寧Zepzelca肺癌藥物在韓國獲得批准
Boryung 表示,其 Zepzelca(成分:lurbinectedin)於 2017 年獲得了食品藥品安全部的產品批准,Zepzelca 是一種小細胞肺癌(SCLC)藥物,由西班牙製藥公司 PharmaMar 許可使用。根據批准,醫院可以使用該藥物治療一線鉑類化療失敗的轉移性 SCLC 患者。一般來說,SCLC早期容易轉移,且進展速度比非小細胞肺癌(NSCLC)快。即使經過治療,SCLC 的複發率也很高。 對於 SCLC 治療中典型的鉑類治療,Boryung 預計 Zepzelca 將成為已產生耐藥性或複發患者的新治療選擇。 Boryung 說,此外,由於患者可以每天接受 Zepzelc... 查看详情
12
7月
新加坡批准ZEPZELCA 治疗晚期小细胞肺癌的新疗法
新加坡患有侵袭性肺癌(转移性小细胞 肺癌 )的患者现在可以获得可能改善预后的新疗法。 药物 ZEPZELCA (lurbinectedin) 已获得 新加坡 健康科学局 (HSA) 临时批准,用于治疗先前接受含铂化疗后病情进展的转移性小细胞肺癌 (SCLC) 成年患者。 这意味着其他现有治疗方案失败的患者现在将有进一步的治疗选择。 ZEPZELCA 是二十多年来 HSA 批准的第一个治疗二线 SCLC 的新疗法,也是专业治疗 (ST) 组合中第三个获得 HSA 批准的肿瘤药物。 新加坡 的 批准是继美国食品和药物管理局 (FDA) 以及澳大利亚治疗用品管理局 (TGA) 的批准之后的 决定。 ... 查看详情
12
7月
Jazz Pharmaceuticals 宣布首位患者入組 IMforte 3 期試驗,評估 Zepzelca® (lurbinectedin) 與 PD-L1 抑製劑聯合治療小細胞肺癌的效果
都柏林,2021 年 11 月 30 日/美通社/ — Jazz Pharmaceuticals plc(納斯達克股票代碼:JAZZ)今天宣布,第一位患者已入組一項 3 期臨床試驗,該試驗評估 Zepzelca ® (lurbinectedin) 與 PD-L1 抑製劑 Tecentriq ® 的聯合用藥(atezolizumab)作為廣泛期小細胞肺癌(ES-SCLC)患者的一線維持治療。該試驗 IMforte 與 F. Hoffmann-La Roche Ltd 合作進行,將測量Zepzelca和Tecentriq聯合用藥與單獨使用Tecentriq相比的無進展生存期和總生存期益... 查看详情