19
10月
FDA批准VYALEV用于晚期帕金森病成年患者
帕金森病是一种渐进性的神经系统疾病,影响了全球数以百万计的患者。随着病情的进展,患者会经历运动障碍的波动,导致日常活动受限,生活质量下降。虽然现有的治疗手段在一定程度上能够帮助缓解症状,但随着疾病的加重,传统药物的效果逐渐减弱。为了应对这一挑战,AbbVie公司近日推出了一种全新的治疗方案——VYALEV™(foscarbidopa/foslevodopa),这是一种24小时连续皮下输注的左旋多巴(levodopa)治疗方法,专为晚期帕金森病患者设计。 革命性的治疗方式:VYALEV™的推出 VYALEV™作为首个也是唯一一个24小时连续皮下输注的左旋多巴治疗方法,标志着帕金森病治疗的一次重大... 查看详情
19
10月
FDA批准Vyloy联合化疗用于CLDN18.2阳性胃癌或胃食管结合部腺癌
近年来,随着医学技术的进步,癌症的治疗方法也在不断创新,尤其是在胃癌和胃食管结合部癌的治疗领域。然而,尽管已有多种治疗选择,许多患者在现有疗法下仍面临效果有限的困境。美国食品药品监督管理局(FDA)最近批准了一种新药Vyloy(Zolbetuximab),为特定类型的胃癌和胃食管结合部腺癌患者提供了一种全新的治疗方案。该药物结合了氟嘧啶类和铂类化疗药物,专为Claudin 18.2 (CLDN18.2) 阳性的HER2阴性肿瘤患者设计。 Vyloy的临床试验成果 Vyloy的批准主要基于两项关键的三期临床试验——SPOTLIGHT和GLOW。这两项研究分别测试了该药物在不同化疗组合下的疗效。 ... 查看详情
18
10月
Gepotidacin用于女性成人及青少年的非复杂性尿路感染获FDA优先审查
近年来,随着抗生素耐药性的增加,治疗感染性疾病的难度逐渐加大。尤其是女性常见的尿路感染(uUTI),由于传统药物的治疗效果逐渐减弱,患者的生活质量受到了严重影响。针对这一问题,GSK公司研发出一种全新的抗生素Gepotidacin,它以独特的机制对抗病原体,可能成为未来治疗uUTI的关键选择。本文将详细介绍Gepotidacin的临床试验结果及其潜在应用,探讨这一创新药物如何改变尿路感染的治疗格局。 尿路感染的现状与挑战 尿路感染是女性中最常见的感染性疾病之一,据统计,超过一半的女性一生中至少会经历一次尿路感染。虽然大多数感染可以通过抗生素治愈,但有约30%的女性会经历复发性尿路感染,这使得她... 查看详情
18
10月
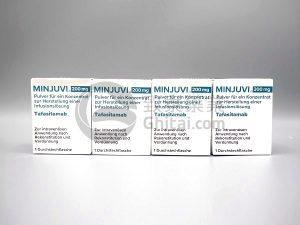
Minjuvi联合Revlimid用于复发/难治性弥漫性大B细胞淋巴瘤在墨西哥获批
在治疗复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)的领域中,传统的化疗和干细胞移植虽有显著疗效,但并非所有患者都适合接受这些治疗。为了应对这些挑战,新的免疫疗法不断涌现。Minjuvi(Tafasitamab)与Revlimid(Lenalidomide)的联合疗法为那些无法接受自体干细胞移植(ASCT)的DLBCL患者带来了新的治疗选择。近期,墨西哥卫生监管机构OFEPRIS批准了这种联合疗法及后续的单药维持治疗方案,这一决策标志着DLBCL治疗进展的重要一步。 墨西哥批准Minjuvi与Revlimid联合治疗 墨西哥卫生监管机构OFEPRIS批准了Minjuvi(Tafasitamab... 查看详情
16
10月
特瑞普利单抗(Toripalimab)在印度和香港获批用于治疗复发/转移性鼻咽癌
鼻咽癌是一种主要发生在亚洲地区,尤其是在中国和东南亚地区的恶性肿瘤。尽管近年来医学科技的进步大幅提高了治疗效果,但对于复发性或转移性鼻咽癌,治疗选择依然有限。特瑞普利单抗(Toripalimab),一种新型免疫治疗药物,近期在印度和中国香港特别行政区获得批准,用于治疗复发性或转移性鼻咽癌。这一新药的获批标志着鼻咽癌治疗领域的一个重要进展,提供了新的治疗方案,尤其是在患者对传统治疗产生耐药性或无法进行手术的情况下。 特瑞普利单抗(Toripalimab)的多重应用 特瑞普利单抗(Toripalimab)不仅在治疗复发性鼻咽癌方面表现突出,同时也适用于多种鼻咽癌的临床情境。首先,特瑞普利单抗(To... 查看详情
16
10月
FDA批准IMULDOSA作为Stelara(乌司奴单抗)仿制药用于治疗慢性炎症
近年来,随着生物制药技术的不断进步,仿制药领域也逐渐扩展至生物类似药的开发。这类药物不仅能提供与原研药相似的疗效,还为患者提供了更具成本效益的选择。Accord BioPharma作为美国Intas Pharmaceuticals旗下的专业部门,专注于肿瘤学、免疫学及关键护理药物的开发,并通过FDA的批准,推出了IMULDOSA,一种STELARA的生物类似药。这一举措不仅丰富了该公司现有的生物类似药产品组合,也为慢性炎症性疾病患者提供了新的治疗选择。 IMULDOSA的获批背景 Accord BioPharma于2024年10月14日宣布,美国食品药品监督管理局(FDA)正式批准其生物类似药... 查看详情
15
10月
达洛鲁胺(Nubeqa,Darolutamide)联合ADT治疗mHSPC申请欧盟批准
近日,欧洲药品管理局(EMA)收到了一项申请,寻求将达洛鲁胺(Nubeqa,Darolutamide)联合雄激素剥夺疗法(ADT)用于转移性激素敏感性前列腺癌(mHSPC)的治疗。这项申请由Orion公司提出,并得到了合作伙伴拜耳的支持。这标志着达洛鲁胺在治疗前列腺癌的应用上迈出了重要一步。 达洛鲁胺与个体化治疗的潜力 拜耳全球产品战略和商业化执行副总裁Christine Roth表示:“每个mHSPC患者的需求都不同,医生需要多样的治疗选择,以便为患者量身定制最佳治疗方案,无论是否使用化疗。”达洛鲁胺与ADT的联合治疗正是基于这种个性化需求,力求在延长患者生存时间、延缓疾病进展的同时,最大限... 查看详情
13
10月
FDA批准Inavolisib联合标准疗法用于PIK3CA突变型乳腺癌治疗
在全球范围内,乳腺癌一直是女性最常见的恶性肿瘤之一,尤其是激素受体阳性、HER2阴性的乳腺癌亚型更为普遍。为了有效治疗这类乳腺癌,靶向疗法的重要性日益凸显。最近,美国食品药品监督管理局(FDA)批准了Inavolisib与Palbociclib及Fulvestrant联合用药,用于治疗PIK3CA基因突变的激素受体阳性(HR+)、HER2阴性(HER2-)乳腺癌患者。这一批准为临床治疗提供了新的选择,并基于III期INAVO120研究的积极数据结果。 PIK3CA基因突变的临床意义 PIK3CA基因突变在HR+、HER2-乳腺癌患者中占约40%的比例,是一种与疾病进展和治疗抗性密切相关的基因突... 查看详情
12
10月
FDA授予LMP744神经胶质瘤孤儿药资格认定
胶质瘤是一种恶性程度较高的脑肿瘤,治疗选择十分有限,患者的预后普遍较差。近年来,科学家们不断探索新的治疗途径,希望能够打破现有疗法的局限,改善患者的生存率和生活质量。LMP744是一种基于拓扑异构酶I抑制剂的小分子药物,最近获得了美国食品药品监督管理局(FDA)的孤儿药资格认定。这一认定不仅意味着LMP744在治疗胶质瘤领域中的潜力,也为该药物的后续临床试验和应用铺平了道路。 LMP744的作用机制 LMP744作为一种拓扑异构酶I抑制剂,其独特的作用机制使其能够有效穿越血脑屏障,这一特性对治疗中枢神经系统肿瘤尤为重要。LMP744能够以高于杀灭癌细胞所需浓度十倍的剂量进入大脑,并在体内维持至... 查看详情
12
10月
辉瑞HYMPAVZI(marstacimab)用于A型或B型血友病成人及青少年治疗获FDA批准
血友病是一种罕见的遗传性出血疾病,影响全球超过80万人,主要由于凝血因子VIII(血友病A)或IX(血友病B)的缺乏,导致患者在受伤或自发性情况下无法正常止血。近年来,随着医学技术的不断进步,针对血友病的治疗手段有了显著提升。近日,美国食品药品监督管理局(FDA)批准了Pfizer开发的HYMPAVZI(marstacimab-hncq),为血友病A和B患者提供了一种新的预防性治疗方案。 HYMPAVZI:创新的抗组织因子通路抑制剂 HYMPAVZI是一种新型的抗组织因子通路抑制剂(anti-TFPI),这是美国市场上首款用于血友病A或B患者的此类药物。与传统的静脉输注疗法相比,HYMPAVZ... 查看详情