10
11月
FDA和EMA接收皮下达雷木单抗(Darzalex)用于高风险潜伏性骨髓瘤的申请
多发性骨髓瘤(MM)是一种复杂且具有高度侵袭性的血液恶性肿瘤,在患者发展为症状性疾病之前,通常会经历一段“潜伏性多发性骨髓瘤”(SMM)阶段。对高风险的SMM患者进行早期干预,可能有效延缓或防止疾病进展为活跃性骨髓瘤。近期,FDA和欧洲药品管理局(EMA)正在审查新型治疗方案,即皮下注射的达雷木单抗(Darzalex,Daratumumab)单药疗法,期望为高风险的SMM患者提供一种安全、有效且可操作的治疗选择。 治疗需求:高风险SMM的挑战 SMM患者虽然没有明显的症状,但他们中部分人群(尤其是高风险患者)存在较高的疾病进展可能性,可能在短期内发展为更为危急的活跃性多发性骨髓瘤。现有的观察和... 查看详情
09
11月
FDA批准Aucatzyl(obe-cel)用于复发或难治性B细胞前体急性淋巴细胞白血病
急性淋巴细胞白血病(ALL)是一种侵袭性极强的血液肿瘤疾病,尤其在成人复发性或难治性病例中,患者生存前景较为暗淡。长期以来,医界面临着亟待突破的治疗需求,以改善这些患者的治疗效果和生活质量。近期,美国食品药品监督管理局(FDA)批准了新型CAR-T细胞疗法——obecabtagene autoleucel(商品名:Aucatzyl,简称obe-cel),用于治疗复发或难治性B细胞前体急性淋巴细胞白血病的成年患者。这一治疗的诞生基于FELIX临床试验的结果,试验数据证实了该药物的显著疗效。 obe-cel的疗法机制与特点 Obe-cel是一种嵌合抗原受体T细胞(CAR-T)疗法,属于近年来创新性... 查看详情
08
11月
Dupixent(dupilumab,度普利尤单抗)治疗儿童嗜酸性粒细胞性食管炎获欧盟批准
近年来,嗜酸性粒细胞性食管炎(EoE)在儿童中的发病率逐渐上升,这种慢性疾病影响了孩子的进食能力,对他们的生长发育构成了巨大挑战。嗜酸性粒细胞性食管炎会导致吞咽困难、呕吐、食欲下降等症状,严重时甚至影响儿童的体重增长。然而,传统的治疗方法往往难以有效控制病情。2024年11月6日,Regeneron Pharmaceuticals和Sanofi公司宣布,欧洲委员会(EC)已批准Dupixent®(dupilumab)用于治疗1至11岁儿童的嗜酸性粒细胞性食管炎,为这一脆弱群体带来了全新的治疗选择。 新疗法的重要性 Dupixent的批准是基于一项III期临床试验的数据,试验结果显示,Dupix... 查看详情
07
11月
芦可替尼乳膏(Opzelura)用于治疗非节段型白癜风在香港获批上市
近年来,白癜风的治疗在全球范围内逐渐引起了广泛关注。作为一种自身免疫性疾病,白癜风不仅影响外观,还对患者的心理造成了极大的负担。然而,治疗白癜风的有效药物选择仍然有限,许多患者难以得到满意的疗效。近日,中国医药系统控股有限公司(CMS)宣布,其用于治疗非节段型白癜风的药物——Ruxolitinib磷酸酯乳膏(芦可替尼/鲁索替尼乳膏,商品名Opzelura)的新药申请在香港获得批准。这一重要进展标志着白癜风患者在治疗选择上将迎来新的突破。 Opzelura(芦可替尼乳膏)的作用机制与特点 Opzelura(芦可替尼乳膏)是由Incyte公司研发的一种外用JAK1/JAK2选择性抑制剂。其主要特点... 查看详情
06
11月
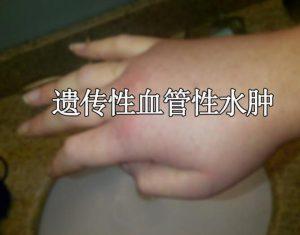
FDA接受Donidalorsen的新药申请用于预防性治疗遗传性血管性水肿
遗传性血管性水肿(HAE)是一种罕见的遗传性疾病,其特征是患者体内发生反复且严重的肿胀(血管性水肿),这些肿胀可能发生在手、脚、生殖器、胃部、面部乃至喉部。尽管现有治疗可以缓解症状,但许多HAE患者依然面临着突破性发作,给他们的生活带来极大困扰。Ionis Pharmaceuticals近日宣布,其研发的RNA靶向药物——Donidalorsen已经获得了美国FDA对新药申请(NDA)的审查许可,这为患者提供了新的希望。 Donidalorsen的研发背景 Donidalorsen是一种针对血管性水肿的RNA靶向药物,旨在通过减少前激肽释放酶(prekallikrein,PKK)的生产来阻断引... 查看详情
06
11月
Emrosi(米诺环素缓释胶囊)治疗玫瑰痤疮(酒渣鼻)获得FDA批准
近年来,皮肤病领域的创新治疗不断取得进展,而玫瑰痤疮(酒渣鼻)作为一种慢性皮肤疾病,给许多患者的生活带来了困扰。此病通常表现为面部的红斑、丘疹及脓疱,且患者常面临治疗选择有限的问题。2024年11月,Journey Medical Corporation宣布,其研发的Emrosi™(盐酸米诺环素缓释胶囊 40mg)获得美国食品药品监督管理局(FDA)批准,用于治疗成人的炎性玫瑰痤疮(酒渣鼻)。这一批准为广泛的玫瑰痤疮患者提供了新的治疗方案,也为医学界提供了更多关于这一疾病管理的可能性。 Emrosi™的FDA批准背景 Journey Medical Corporation是一家专注于皮肤科药物... 查看详情
02
11月
Avutometinib联合Defactinib组合疗法用于复发性KRAS突变低级别浆液性卵巢癌申请FDA批准
在卵巢癌的多种类型中,低度浆液性卵巢癌(Low-Grade Serous Ovarian Cancer, LGSOC)被认为是一种预后较差、治疗选择有限的癌症。由于其进展缓慢,且对化疗及其他传统治疗手段的反应较弱,尤其是伴有KRAS基因突变的LGSOC,治疗难度进一步加大。近期,Verastem公司针对KRAS突变的复发性LGSOC患者研发了一种新型药物组合——Avutometinib与Defactinib,并向美国食品药品监督管理局(FDA)递交了新药申请。这一组合疗法已显示出良好的抗肿瘤活性,有望成为KRAS突变LGSOC患者的有效治疗选择。 Avutometinib与Defactinib... 查看详情
31
10月
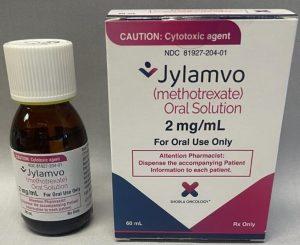
FDA将Jylamvo的批准范围扩大到儿童急性淋巴细胞白血病和幼年特发性关节炎
美国食品药品监督管理局(FDA)近日批准Jylamvo(甲氨蝶呤)扩展适应症,涵盖了儿童急性淋巴细胞白血病及多关节型幼年特发性关节炎。这一批准不仅使Jylamvo成为唯一适用于儿童和成人的口服液体甲氨蝶呤配方,更提供了一种符合患者需求的便利药物选择,标志着Jylamvo在儿科肿瘤和自身免疫疾病治疗领域的重要进展。 便捷的儿童用药选择:从药片到口服液体 Jylamvo作为一种甲氨蝶呤口服液体剂型,为需要长期用药的儿童患者带来便捷的解决方案。传统的甲氨蝶呤药物多为片剂,尤其对小儿患者来说,难以下咽的固体药片成为治疗中的不便因素。而Jylamvo以橙味液体形式提供,不需分割药片或将其研磨成粉。此举不... 查看详情
31
10月
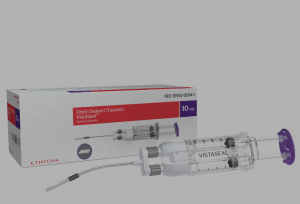
FDA批准Vistaseal纤维蛋白密封剂用于控制儿科患者手术出血
最近,美国食品药品监督管理局(FDA)批准了一种基于血浆蛋白的止血剂——Vistaseal,专为控制儿科患者的手术出血而设计。这一决定标志着在外科手术中减少儿童出血和并发症的新方法的诞生。 Vistaseal的工作原理 Vistaseal结合了纤维蛋白原和凝血酶两种蛋白质,通过约翰逊公司(Johnson & Johnson)的无气喷雾技术快速形成血块,从而促进止血和组织封闭。这种产品在术中以薄层涂抹于出血组织上,形成交联的纤维蛋白血块,帮助实现有效的止血。这种新技术的引入,对于传统缝合或烧灼等标准手术技术不够有效的轻度至中度出血,提供了一个理想的替代方案。 临床研究成果 在一项全球范围... 查看详情
30
10月
NCCN指南更新推荐Kisqali(瑞波西利)联合AI辅助治疗HR+/HER2–早期乳腺癌
随着对乳腺癌治疗方法的不断研究和探索,临床实践指南的更新成为了临床医生在选择最佳治疗方案时的重要参考。最近,美国国家综合癌症网络(NCCN)对其乳腺癌临床实践指南进行了更新,推荐将Kisqali(Ribociclib,瑞波西利)与芳香化酶抑制剂(AI)联合使用,作为一种优先的CDK4/6抑制剂方案,用于早期雌激素受体阳性/HER2阴性乳腺癌患者的辅助治疗。这一指导方针的出台,标志着治疗策略的进一步优化,也为高风险患者提供了新的治疗选择。 NCCN指南的更新 2024年10月15日,NCCN发布了最新的乳腺癌临床实践指南(第5版),明确将Kisqali(瑞波西利)与芳香化酶抑制剂联合使用列为辅助... 查看详情