25
7月
FDA扩展A型肉毒杆菌毒素Xeomin适应症纳入上脸部皱纹治疗
近期,Merz Aesthetics宣布,美国食品和药物管理局(FDA)正式批准扩展Xeomin(incobotulinumtoxinA,肉毒杆菌毒素A)的适应症范围,涵盖了成人上脸部皱纹的治疗。这一扩展使得Xeomin成为第一个也是唯一一个能够同时治疗额头皱纹、眉间纹和鱼尾纹的神经毒素。 Xeomin的适应症扩展背景 自2011年起,Xeomin已经获得FDA的批准,用于暂时改善中度至重度眉间纹的外观。此次更新后,新的适应症包括与皱眉肌和降眉间肌活动相关的中度至重度眉间线(GL);与额肌活动相关的中度至重度额头水平线(HFL);以及与眼轮匝肌活动相关的中度至重度外眦线(LCL)。这一更新标志... 查看详情
24
7月
Tivdak(Tisotumab Vedotin)在复发性宫颈癌中继续显示生存益处
在宫颈癌治疗领域,Tivdak(Tisotumab Vedotin)作为二线或三线治疗方案,显示出优于传统化疗的显著疗效。在一项名为innovaTV 301/ENGOT-cx12/GOG-3057(NCT04697628)研究的预定中期分析中,研究结果表明,Tivdak能够显著提高患者的总生存期(OS)。 总生存期和无进展生存期的显著改善 在Tivdak治疗组中,患者的总生存期达到了11.5个月(95% CI, 9.8-14.9),而在化疗组中,总生存期为9.5个月(95% CI, 7.9-10.7)。这意味着,与化疗相比,使用Tivdak治疗的患者死亡风险降低了30%(HR, 0.70; 9... 查看详情
24
7月
Epysqli(依库珠单抗)治疗阵发性睡眠性血红蛋白尿和非典型溶血性尿毒症综合征获FDA批准
近日,三星生物制药有限公司宣布,其开发的 Epysqli® (eculizumab-aagh,依库珠单抗) 已获得美国食品药品管理局 (FDA) 的批准,作为 Soliris (eculizumab) 的生物仿制药正式上市。这一消息无疑为药物市场带来了重大的变革,特别是在治疗某些罕见疾病方面。 Epysqli®的临床价值与应用 Epysqli® 作为一种补体抑制剂,主要用于治疗两种罕见疾病:阵发性睡眠性血红蛋白尿 (PNH) 和非典型溶血性尿毒症综合征 (aHUS)。这两种疾病的共同特点是由补体系统异常活化引发的病理性溶血和血栓性微血管病,严重影响患者的生活质量。 1. 阵发性睡眠性血红蛋白尿... 查看详情
24
7月
Tecvayli(Teclistamab,特立妥单抗)获NICE推荐治疗多发性骨髓瘤
近日,强生公司(J&J)研发的Tecvayli(Teclistamab,特立妥单抗)获得了英国国家健康和护理卓越研究所(NICE)的推荐,被批准用于治疗英格兰和威尔士的复发性和难治性多发性骨髓瘤(RRMM)成年患者。这一决定对于那些已经接受过至少三种先前治疗且病情在最后一次治疗中有所进展的患者,提供了一种新的治疗选择。这些患者原本将接受泊马度胺加地塞米松(pom-dex)治疗,而Tecvayli的引入,为他们带来了新的希望。 多发性骨髓瘤的挑战与治疗需求 多发性骨髓瘤是一种无法治愈的血液癌症,它影响一种称为浆细胞的白细胞。在这种疾病中,浆细胞异常增殖并扩散,取代了骨髓中的正常细胞。大多... 查看详情
23
7月
Uzpruvo治疗克罗恩病、银屑病关节炎和斑块状银屑病在欧盟获批
欧洲推出的突破性药物 近日,德国巴特菲尔贝尔和冰岛雷克雅未克的制药公司STADA和Alvotech宣布,在大多数欧洲国家成功推出了名为Uzpruvo®的生物仿制药。这款药物是欧洲首个获批的Stelara®(Ustekinumab)生物仿制药,标志着生物仿制药市场的重要里程碑。 Uzpruvo的批准与适应症 今年1月,Uzpruvo成功获得欧盟委员会的批准,成为首个乌司他单抗的生物仿制药。Uzpruvo在疗效、安全性、药代动力学和免疫原性方面与Stelara®参考产品相当。其适应症包括成人克罗恩病和银屑病关节炎,以及成人和6岁以上儿童的斑块状银屑病。然而,由于原研公司仍拥有溃疡性结肠炎适应症的独... 查看详情
21
7月
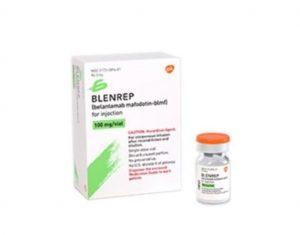
EMA接受Blenrep(belantamab mafodotin)组合治疗复发/难治性多发性骨髓瘤的上市许可申请
近期,欧洲药品管理局(EMA)正式接受了关于belantamab mafodotin(商品名:Blenrep)联合bortezomib(商品名:Velcade)和地塞米松(BVd),或联合泊马度胺(商品名:Pomalyst)和地塞米松(BPd)治疗复发或难治性多发性骨髓瘤患者的上市授权申请。这一申请基于DREAMM-7和DREAMM-8两项III期临床试验的中期数据,这两项试验均显示,belantamab mafodotin组合方案在无进展生存期(PFS)方面较标准治疗方案(SOC)有显著改善。 DREAMM-7和DREAMM-8试验的初步成果 在DREAMM-7试验中,接受BVd治疗的患者(... 查看详情
21
7月
vimseltinib用于治疗腱鞘巨细胞瘤获欧盟药品管理局受理
近日,欧洲药品管理局(EMA)正式受理了一项关于靶向药物vimseltinib的市场授权申请(MAA),该药物被提议用于治疗腱鞘巨细胞瘤(TGCT)患者。这一进展意味着vimseltinib有望成为这种罕见病的新疗法,给众多需要有效且耐受性良好治疗的 TGCT 患者带来希望。 关键临床试验 MOTION 的积极结果 这一市场授权申请是基于一项名为 MOTION 的三期临床试验(NCT05059262)的结果。该试验是一项国际性、随机、双盲、安慰剂对照的研究,共纳入了83名确诊为有症状 TGCT 的患者,另有40名患者接受安慰剂治疗。研究结果显示,在第25周时,vimseltinib治疗组的客观... 查看详情
19
7月
FDA授予树突状细胞疫苗DOC1021治疗胰腺癌的快速通道地位
美国食品药品监督管理局(FDA)已经批准Diakonos Oncology公司开发的树突状细胞疫苗(DCV)DOC1021,用于胰腺导管腺癌(PDAC)患者的快速通道资格。此次批准基于该疫苗在I期临床试验中展现出的良好疗效,尤其是对于胶质母细胞瘤(GBM)患者的显著生存期延长。 DOC1021疫苗在胶质母细胞瘤中的初步成功 在2024年美国癌症研究协会年会上,研究人员展示了DOC1021疫苗在I期临床试验中的成果。数据显示,受试的胶质母细胞瘤患者中位总生存期尚未达到,12个月生存率高达88%,这与传统治疗方法相比是一个显著的提升。在16名可评估的GBM患者中,有12名仍然存活,并且没有出现严重... 查看详情
19
7月
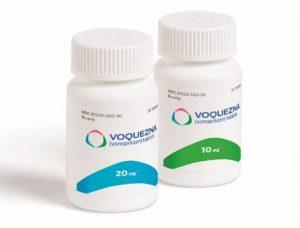
VOQUEZNA(Vonoprazan,沃诺拉赞)用于非糜烂性胃食管反流病治疗获FDA批准
2024年7月18日,Phathom Pharmaceuticals, Inc.公司宣布,美国食品药品管理局(FDA)已正式批准VOQUEZNA®(vonoprazan,沃诺拉赞)10mg片剂用于缓解成人非糜烂性胃食管反流病(Non-Erosive GERD)相关的胃灼热症状。这一重要决定为广大患者提供了一种全新的治疗选择,并为非糜烂性GERD的药物治疗开辟了新的篇章。 关键研究:PHALCON-NERD-301的成功 VOQUEZNA®获得批准的背后,是PHALCON-NERD-301研究的强力支撑。这项研究是一项3期随机、安慰剂对照、双盲、多中心的美国研究,主要评估VOQUEZNA在非糜烂... 查看详情
18
7月
FDA授予Ebvallo(Tabelecleucel)治疗成人和儿童EBV+移植后淋巴增生性疾病优先审查资格
2024年,美国食品药品监督管理局(FDA)接受了一项生物制品许可申请(BLA),旨在批准tabelecleucel(tab-cel)作为单药疗法,用于治疗2岁及以上的儿童和成人患者,这些患者在经历至少一次治疗后,仍然患有EBV(Epstein-Barr病毒)阳性移植后淋巴增生性疾病(PTLD)。此外,FDA还为此申请授予了优先审查资格,目标审查日期定为2025年1月15日。 无其他获批疗法下的突破 目前,FDA尚未批准任何治疗EBV阳性PTLD的药物。此次申请的支持数据来源于430多名患有多种危及生命疾病的患者,这些患者接受了tab-cel的治疗,包括关键的3期ALLELE试验(NCT033... 查看详情