18
9月
FDA已接受Ensifentrine用于慢性阻塞性肺疾病维持治疗的新药申请
慢性阻塞性肺疾病(COPD)是一种常见且严重的呼吸系统疾病,它影响着数百万人的生活质量。 虽然已有多种药物用于COPD的治疗,但长期以来,新的治疗机制和药物一直相对缺乏。 然而,最近的消息为COPD患者带来了新的希望。 Verona Pharma plc宣布美国食品和药物管理局(FDA)已接受了该公司的新药申请(NDA),该申请旨在获得对ensifentrine用于COPD患者维护治疗的批准。 这一消息为COPD患者提供了一线希望,如果获批准,ensifentrine将成为十多年来首个用于COPD维护治疗的全新机制药物。 COPD患者或将有新的治疗选择 2023年9月11日,Verona Ph... 查看详情
18
9月
降压药物Lorundrostat在难控制的高血压患者中的有效性
高血压是一种常见的心血管疾病,它增加了患者心脏疾病和中风的风险。虽然有多种降压药物可供选择,但仍然存在一部分患者的血压无法得到有效控制。在这方面,一项最新的研究为我们带来了一线希望。据美国医学会杂志(Journal of the American Medical Association)于2023年9月10日在线发布的一项研究报告称,醛固酮合成酶抑制剂Lorundrostat在难以控制的高血压患者中降低血压方面表现出显著的效果。本研究结果不仅为高血压治疗领域带来新的突破,还为患者提供了更多降压药物选择的可能性。 研究背景 高血压是一种常见的慢性疾病,全球范围内影响着数百万人的生活质量。尽管已经... 查看详情
17
9月
FDA审批新配方Ingrezza治疗迟发性运动障碍和亨廷顿舞蹈病
在医学领域,不断创新和改进治疗方法是为数不多的重要任务之一。最近,制药公司Neurocrine Biosciences的一项新药申请引起了广泛关注,该公司提出了Ingrezza治疗迟发性运动障碍和亨廷顿舞蹈病的全新配方。这一举措不仅有望改善患者的用药体验,还可能为那些吞咽困难或不愿意服用整颗胶囊的患者提供更为便捷的治疗选择。 新配方介绍 Neurocrine Biosciences宣布,美国食品和药物管理局(FDA)已经接受了他们的新药申请(NDA),该申请涉及Ingrezza(valbenazine,缬苯那嗪)的口服颗粒剂。这个新配方是针对迟发性运动障碍和亨廷顿舞蹈病的治疗而设计的,而FDA... 查看详情
15
9月
中国已受理Golidocitinib用于治疗复发/难治性外周T细胞淋巴瘤的新药申请
中国国家药品监督管理局(NMPA)的药品评估中心已经受理了新药申请,该申请旨在获得golidocitinib用于治疗复发/难治性外周T细胞淋巴瘤(PTCL)患者的批准。 改善治疗前景 对于患有复发/难治性外周T细胞淋巴瘤的患者来说,治疗前景一直相对有限。然而,近期的临床研究表明,golidocitinib(AZD4205)可能为这一患者群体带来新的曙光。该药物已经提交了新药申请,希望获得在中国治疗PTCL的批准。 临床试验结果 申请的依据是来自1/2期JACKPOT8试验(NCT04105010)B部分的数据。截至2023年2月16日的数据显示,根据独立审查委员会的评估,golidocitin... 查看详情
15
9月
NICE推荐Ruxolitinib(Jakafi)治疗羟酰胺/羟脲耐药或不耐受的真性红细胞增多症
对于英格兰和威尔士的多血症(Polycythemia Vera,PV)患者,有了一项重要的好消息。国家卫生与护理卓越研究所(NICE)最近发布了最终草案指南,推荐将Ruxolitinib(Jakafi)用作对抗对羟基脲(HC/HU)耐药或不耐受的PV患者的治疗方法。 提高患者生活质量 PV是一种血液疾病,对患者的日常生活产生了极大的负担。伦敦盖伊和圣托马斯国立卫生与护理基金会信托的血液科顾问Claire Harrison博士在一份新闻稿中表示:“对于英格兰和威尔士的PV患者来说,存在着显著的未满足需求,他们由于这种疾病而承受着巨大的症状负担。”2017年,MPN LANDMARK调查的结果表明... 查看详情
15
9月
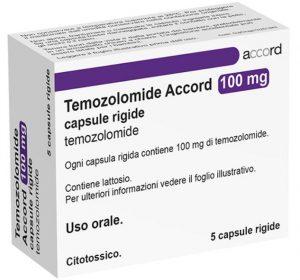
FDA批准替莫唑胺Temodar治疗间变性星形细胞瘤的新适应症
肿瘤治疗领域的突破性进展一直是医学界和患者关注的焦点。近日,美国食品药品监督管理局(FDA)发布了一项重要决定,批准了替莫唑胺(Temozolomide,商业名为Temodar)在治疗恶性胶质母细胞瘤领域的新适应症。这一决定将影响到那些患有侵袭性星形胶质细胞瘤(Anaplastic Astrocytoma)的成年患者,为他们提供了更多的治疗选择。此外,FDA还在“项目更新(Project Renewal)”的框架下,对替莫唑胺的适应症进行了修订,以更好地满足一些难治性星形胶质细胞瘤患者的需求。 批准新的适应症 首先,让我们关注这项重大决定的第一部分:FDA批准了替莫唑胺作为成年患者新诊断的侵袭... 查看详情
15
9月
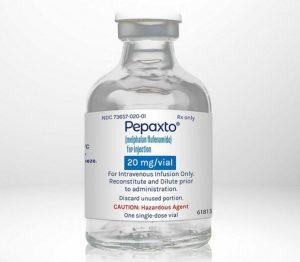
多发性骨髓瘤新药Pepaxti(Melphalan Flufenamide)扩大适应症欧盟获认可
复发/难治性多发性骨髓瘤(MM)是一种具有挑战性的血液系统肿瘤,对于这些患者,寻找有效的治疗方案至关重要。近期,欧洲药品管理局的人用药品委员会(CHMP)针对一项类型II变更申请,就批准将Melphalan Flufenamide(Pepaxti)的治疗适应症扩展至复发/难治性多发性骨髓瘤的成年患者,这些患者曾接受至少2种先前的治疗方案,而且对来那度胺(Lenalidomide)和最后一线治疗产生了耐药性,提出了积极意见。 研究支持 这一申请得到了来自3期OCEAN研究(NCT03151811)的发现的支持。在该研究中,Melphalan Flufenamide联合地塞米松的治疗(n = 24... 查看详情
15
9月
Resmetirom治疗非酒精性脂肪性肝炎获FDA优先审查
非酒精性脂肪性肝炎(NASH)是一种日益严重的肝脏疾病,它在非酒精性脂肪性肝病(NAFLD)的基础上发展而来,可能导致肝纤维化、肝硬化,甚至肝癌。然而,至今尚没有FDA批准的治疗NASH的药物。然而,希望的曙光出现了,Madrigal Pharmaceuticals制药公司宣布,美国食品药品监督管理局(FDA)已同意优先审查Resmetirom的新药申请(NDA),为NASH患者提供了新的治疗前景。 NASH的背景 非酒精性脂肪性肝炎(NASH)是非酒精性脂肪性肝病(NAFLD)的进展阶段,其特点是肝脂肪积累、炎症和肝纤维化。这一疾病逐渐成为美国肝移植的主要原因,并对患者的生命产生了严重威胁。... 查看详情
15
9月
改善A型血友病治疗:FDA接受Altuviiio更新标签
A型血友病,又称甲型血友病,是一种罕见的遗传性疾病,特点是凝血蛋白VIII水平降低,导致患者容易发生出血。这种疾病对患者的生活质量产生了极大的影响,尤其是对于年幼的患者。近期,美国食品药品监督管理局(FDA)接受了Altuviiio的补充生物制品许可申请,将该药物的使用扩展到12岁以下患有严重A型血友病的儿童患者。这一决定基于关键的临床研究数据,为改善患者的治疗提供了新的希望。 Altuviiio的背景 Altuviiio,通用名为抗血友病因子(重组),FC-VWF-XTEN融合蛋白,是一种高持续性因子VIII替代疗法。它旨在提供有效的出血保护,降低A型血友病患者的出血风险。此前,FDA已经批... 查看详情
14
9月
FDA授予Tulmimitostat治疗子宫内膜癌症的快速通道地位
子宫内膜癌(endometrial cancer)是一种妇女常见的癌症,但对于某些患者,特别是那些病情晚期、复发或转移的患者,治疗一直是一个巨大的挑战。近期,美国食品药品监督管理局(FDA)为一种新型药物Tulmimetostat(CPI-0209)授予了“快速通道”地位,为这些患者提供了新的治疗选择。 Tulmimetostat:新希望 Tulmimetostat,又称CPI-0209,是一种第二代EZH2/EZH1抑制剂,旨在通过延长与靶点的结合时间,实现全面的靶点覆盖。这一药物的研发是为了治疗一种特定亚型的子宫内膜癌,即携带ARID1A突变的癌症。ARID1A突变使得肿瘤更难治疗,因为它... 查看详情