28
4月
JAQBO(Zastaprazan)治疗侵蚀性胃食管反流病在韩国获批
近日,韩国食品药品安全部(MFDS)宣布批准了JAQBO(zastaprazan柠檬酸盐)用于治疗成人侵蚀性胃食管反流病(GERD)。这一消息在医学界引起了广泛关注。GERD是一种常见的消化系统疾病,给患者带来不适和痛苦。现有的治疗方法并不能完全满足患者的需求。JAQBO的问世,无疑为GERD患者带来了新的希望。 JAQBO的批准 2024年4月25日,Onconic Therapeutics公司正式宣布,韩国食品药品安全部(MFDS)已批准了JAQBO用于治疗成人侵蚀性胃食管反流病(GERD)。这一决定的背后,是基于JAQBO在韩国28个地点进行的III期临床试验的综合结果。这些临床试验表明... 查看详情
28
4月
FDA批准基因疗法Beqvez用于治疗B型血友病
在医学科技的飞速发展中,基因疗法成为了治疗一系列遗传性疾病的新希望。近日,一项重大突破再次引起了人们的关注——辉瑞公司的基因疗法Beqvez(fidanacogene elaparvovec-dzkt)获得美国FDA的批准,用于治疗中重度B型血友病成人患者。这一消息的背后,是对科学技术的不懈探索和创新,也是对人类健康福祉的巨大贡献。 重大突破:Beqvez的批准 2024年4月26日,辉瑞宣布,FDA已正式批准Beqvez用于中重度B型血友病成人患者的治疗。这一决定是在对Beqvez临床试验数据进行了充分审查后做出的,充分显示了其在血友病治疗中的显著疗效和安全性。这意味着,患有B型血友病的患者... 查看详情
28
4月
欧盟批准Kalydeco(Ivacaftor,依伐卡托)用于治疗患有囊性纤维化的婴儿
2024年4月26日,Vertex Pharmaceuticals 宣布了一个重大的里程碑:欧盟委员会已经批准了 Kalydeco® (Ivacaftor,依伐卡托)的扩大适应症,将其用于治疗1个月及以上患有囊性纤维化(CF)的婴儿。这个消息为数万名囊性纤维化患者及其家人带来了新的希望和可能性。 Kalydeco(依伐卡托)的新用途 依伐卡托是一种口服药物,被称为 CFTR 增强剂。在CFTR基因发生特定类型突变的人中,细胞表面的CFTR蛋白无法正常发挥作用。依伐卡托的作用是促进CFTR蛋白跨细胞膜运输盐和水的能力,从而有助于水合和清除气道中的粘液。这使得依伐卡托成为第一种治疗囊性纤维化根本原... 查看详情
27
4月
呋喹替尼(Fruzaqla)用于既往治疗过的转移性结直肠癌获得CHMP的积极评价
欧洲药品管理局委员会(CHMP)表示支持批准呋喹替尼(Fruzaqla)用于先前治疗过的转移性结直肠癌。 随着呋喹替尼(Fruquintinib,Fruzaqla)在先前治疗过的转移性结直肠癌(mCRC)成年患者中获得了欧洲药品管理局人用药品委员会(CHMP)的推荐批准,一种新的治疗选择正逐步进入欧盟(EU)的药物市场。 FRESCO-2试验结果及CHMP的推荐 该积极意见基于多地区3期FRESCO-2试验(NCT04322539)的结果,该试验研究了先前治疗过的mCRC患者中使用呋喹替尼(Fruzaqla)联合最佳支持治疗(BSC;n = 461)与安慰剂加BSC(n = 230)相比的效果... 查看详情
27
4月
FDA批准纳洛酮鼻喷雾剂Rezenopy用于阿片类药物过量的紧急治疗
近年来,阿片类药物过量引发的死亡事件在全球范围内不断上升,成为一项严重的公共卫生挑战。针对这一问题,医学界一直在寻求更有效的紧急治疗方法。最近,一种新型的高剂量纳洛酮鼻喷雾剂Rezenopy(naloxone hydrochloride,盐酸纳洛酮)获得了美国FDA的批准,这一创新将为阿片类药物过量的急救提供更为便捷和有效的选择。 Rezenopy的研发与特点 Rezenopy由Summit生物科学公司研发,是一种阿片类拮抗剂,能够迅速逆转阿片类药物的作用,包括呼吸抑制、镇静和低血压等症状。其独特之处在于单剂量即可输送10毫克盐酸纳洛酮,使其成为一种快速且高效的急救药物。Rezenopy旨在在... 查看详情
26
4月
多塔利单抗(Jemperli)联合化疗扩大子宫内膜癌适应症获FDA优先审查
子宫内膜癌是一种严重的妇科恶性肿瘤,对患者的健康和生活质量造成了巨大影响。近年来,针对这一癌症的治疗方案不断更新,其中多塔利单抗(Jemperli,Dostarlimab)联合化疗作为一项颇受瞩目的治疗方案,正在经历着重大突破。最近,美国食品药品监督管理局(FDA)对多塔利单抗(Jemperli)联合化疗在子宫内膜癌扩展适应症上进行了优先审查,这一消息令医学界和患者们备受鼓舞。 临床试验数据支持 此次FDA的优先审查是基于多塔利单抗(Jemperli)联合化疗的补充生物许可证申请(sBLA),该申请旨在将该疗法扩展至所有初发晚期或复发性子宫内膜癌成年患者,包括具有错配修复蛋白(pMMR)/微卫... 查看详情
26
4月
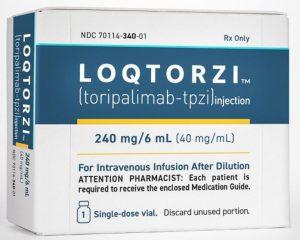
Loqtorzi(特瑞普利单抗)治疗鼻咽癌新药申请正在香港审评
近年来,鼻咽癌作为一种严重的头颈部肿瘤,在世界范围内引起了广泛关注。然而,传统的治疗方法在一些情况下效果有限,迫切需要更有效的治疗手段。在这一背景下,免疫治疗作为一种新型治疗方法,为鼻咽癌患者带来了希望。而随着科技的进步和研究的不断深入,一种名为Loqtorzi(特瑞普利单抗,Toripalimab)的免疫治疗药物正受到越来越多国家的关注和认可。 近日,香港特别行政区政府卫生部药物管理局已受理一项新药申请,该申请旨在批准Loqtorzi(特瑞普利单抗)用于治疗鼻咽癌患者。这一进展为广大患者带来了曙光,也标志着香港在鼻咽癌治疗领域迈出了重要的一步。 JUPITER-02 临床试验结果 JUPIT... 查看详情
25
4月
FDA批准Pivya(Pivmecillinam)用于治疗女性非复杂性尿路感染
尿路感染(UTI)是一种常见的疾病,尤其在女性中较为常见。随着细菌对传统抗生素的耐药性增加,寻找新的治疗方法显得尤为迫切。近期,一种新型口服抗生素Pivya(Pivmecillinam)获得了美国FDA的批准,成为治疗女性非复杂性尿路感染的新选择。 Pivya的临床试验结果 Pivya的临床试验涵盖了多个方面,对其疗效进行了全面评估。通过与安慰剂、其他口服抗菌药物以及抗炎药物的比较,研究人员对Pivya的疗效进行了验证。 在与安慰剂比较的试验中,Pivya表现出明显的优势。在接受Pivya治疗的患者中,有62%达到了复合应答,而接受安慰剂的患者中仅有10%达到此标准。这一结果显示了Pivya在... 查看详情
25
4月
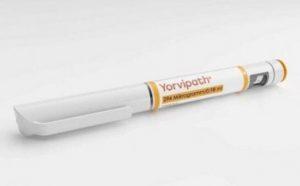
英国批准Yorvipath(Palopegteriparatide)用于治疗慢性甲状旁腺功能减退
甲状旁腺功能减退症(Hypoparathyroidism,HP)是一种内分泌疾病,由于甲状旁腺激素(PTH)水平不足引起。此疾病的治疗一直是医学界的挑战之一。然而,随着科学技术的不断进步,新的治疗方法正在不断涌现。在这篇文章中,我们将重点关注英国近期批准的一项新药物——Yorvipath(Palopegteriparatide),并探讨其在治疗成人慢性甲状旁腺功能减退症方面的意义。 Yorvipath的批准与意义 2024年4月24日,Ascendis Pharma A/S宣布,英国药品和保健品监管局(MHRA)已授予Yorvipath®(palopegteriparatide)作为甲状旁腺激... 查看详情
25
4月
欧盟批准FILSPARI(Sparsentan)用于治疗IgA肾病
2024年4月24日,Travere Therapeutics, Inc.(纳斯达克股票代码:TVTX)和 CSL Vifor 宣布,欧盟委员会已授予 FILSPARI(sparsentan)有条件营销授权 (CMA),用于治疗患有原发性 IgA 肾病 (IgAN) 且尿蛋白排泄量≥1.0 g/天(或尿蛋白与肌酐比值≥0.75 g/g)的成人。 欧盟批准背后的科学基础 欧盟委员会的这一决定是在人用药品委员会 (CHMP) 于2024年2月根据FILSPARI治疗IgAN的关键3期PROTECT研究结果发表积极意见之后做出的。PROTECT研究在预先指定的中期分析中达到了其主要终点,具有统计学意... 查看详情