23
1月
NICE推荐Talazoparib(Talzenna)治疗晚期BRCA1/2突变型HER2-乳腺癌
在乳腺癌治疗领域,新的治疗方案为那些面临局部晚期或转移性HER2阴性乳腺癌的患者带来了新的曙光。英国国家卫生与临床卓越研究所(NICE)最新发布的指南推荐了Talazoparib(Talzenna)作为一线治疗选择,针对患有GERMLINE BRCA1/2突变的成年患者。这一推荐的背后是一系列医学研究和经济评估,以确保该治疗方案的成本效益和资源利用。 NICE最终草案建议使用Talazoparib治疗成年患者,这些患者患有局部晚期或转移性HER2阴性乳腺癌,同时存在GERMLINE BRCA1或BRCA2突变,且在接受蒽环素、紫杉醇或两者治疗后出现疾病进展。这一推荐的颠覆性决定扭转了之前的初步... 查看详情
23
1月
Olverembatinib被添加到美国NCCN慢性髓系白血病治疗最新指南中
随着医学研究的不断进展,慢性髓系白血病(CML)患者的治疗方案也在不断更新。最新的美国国家综合癌症网络(NCCN)指南中引入了第三代BCR-ABL1 TKI药物Olverembatinib,为CML患者的治疗提供了新的选择。这一举措标志着Olverembatinib在肿瘤学领域的重要认可,为CML患者带来更多治疗希望。 Olverembatinib被纳入NCCN最新指南 NCCN最新指南中,Olverembatinib作为第三代BCR-ABL1 TKI药物被引入,用于治疗慢性髓系白血病患者。Olverembatinib于2021年11月在中国获得批准,用于治疗对TKI有抵抗的慢性期CML患者和... 查看详情
23
1月
FDA授予PTX-252用于治疗急性髓系白血病的孤儿药资格
近年来,医学领域的不断进步使得罕见病领域的治疗逐渐引起关注。针对急性髓系白血病(AML)的新型分子药物PTX-252最近获得了美国食品和药物管理局(FDA)的孤儿药物认定。这一认定不仅体现了对罕见病领域的关注,也为AML患者带来了新的治疗希望。本文将深入探讨PTX-252的孤儿药物认定,以及这一新型分子药物在AML治疗中的潜在影响。 PTX-252获FDA孤儿药物认定 PTX-252,一种新型分子药物,已经获得了FDA对急性髓系白血病的孤儿药物认定。这一认定是在Hyloris Pharmaceuticals的申请下完成的。孤儿药物认定通常针对治疗或预防罕见病的药物,这些病症可能对生命构成威胁,... 查看详情
23
1月
Ibrutinib/Venetoclax联合疗法在慢性淋巴细胞白血病中的潜力数据
来自第二阶段CAPTIVATE研究的发现表明,Ibrutinib(Imbruvica,伊鲁替尼)和Venetoclax((Venclyxto,Venclexta,维奈托克,维奈妥拉)的联合疗法可能成为慢性淋巴细胞白血病(CLL)患者的理想治疗方案。 Ibrutinib/Venetoclax联合疗法的潜在优势 CAPTIVATE研究(NCT02910583)的结果显示,Ibrutinib和Venetoclax的联合疗法有望恢复患有慢性淋巴细胞白血病的患者正常的血液免疫组成。研究将患有慢性淋巴细胞白血病的患者随机分为对照组、Ibrutinib组以及Ibrutinib加Venetoclax组,根据是... 查看详情
23
1月
新冠疫苗CORBEVAX获得世界卫生组织紧急使用清单的批准
在全球抗击新冠疫情的过程中,疫苗的研发和使用成为最为关键的环节之一。近日,Biological E的CORBEVAX®疫苗获得了世界卫生组织(WHO)紧急使用清单的批准,为全球疫苗接种工作提供了更为多样化的选择。 CORBEVAX®的背景与研发历程 CORBEVAX®是一种由印度知名全球疫苗供应商Biological E Limited开发的重组蛋白疫苗,采用表达SARS-CoV-2受体结合域(RBD)蛋白的毕赤酵母菌株。这一菌株由德克萨斯儿童医院疫苗开发中心设计(CVD)和贝勒医学院(BCM)提供支持。其研发历程始于德克萨斯儿童医院疫苗开发中心和贝勒医学院综合商业化部门在2020年向Biol... 查看详情
23
1月
XCOPRI(Cenobamate)治疗耐药性局灶性癫痫发作加拿大上市
癫痫是一种慢性神经系统疾病,对患者的生活造成了巨大影响。尽管存在多种抗癫痫药物,但仍有一部分患者因耐药性而无法得到满意的治疗效果。近日,Endo International plc的子公司Paladin Labs Inc.宣布XCOPRI®(cenobamate)片剂已在加拿大上市,为成人耐药性局灶性癫痫患者提供了新的治疗选择。 XCOPRI的疗效与安全性评估 XCOPRI作为辅助治疗药物,针对那些无法通过常规治疗满意控制的成人癫痫患者的部分性癫痫发作。其疗效和安全性在两项随机、安慰剂对照、双盲临床试验(C013和C017)中进行了全面评估。此外,开放标签安全性研究(C021)也对西诺贝酯在该... 查看详情
21
1月
FDA批准非药物系统第二代Monarch eTNS治疗儿童多动症
在医学领域,治疗儿童注意力缺陷/多动症(ADHD)的方法一直备受关注。近日,美国食品药品监督管理局(FDA)批准了NeuroSigma的第二代Monarch外部三叉神经刺激(eTNS)系统Monarch eTNS,成为首个获得FDA认可的非药物治疗儿童多动症的技术。这一消息为儿童多动症患者带来新的希望,也在医疗领域迎来了一次创新的时刻。 ADHD的挑战与争议 ADHD作为一种神经发育障碍,给7至12岁患者带来了认知参与活动中注意力不集中、活动过多、行为冲动等症状。目前,对ADHD的治疗主要包括心理咨询、生活习惯改变、行为疗法和药物。然而,对于在儿童中广泛使用兴奋剂药物的争议始终存在。在这个背景... 查看详情
21
1月
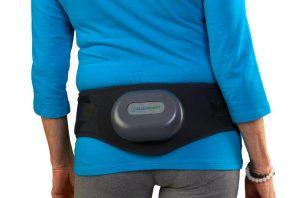
FDA批准处方腰带器械Osteoboost用于治疗低骨密度
近日,Bone Health Technologies取得了重大突破,宣布其首款治疗低骨密度的创新产品——Osteoboost,已经获得美国食品药品监督管理局(FDA)的批准。这一消息标志着绝经后妇女骨质减少的治疗领域迎来了一次革命性的变革。Osteoboost作为非药物处方治疗方法,将填补骨质减少患者长期以来缺乏有效治疗选择的空白,为患者提供了一种新的、创新的骨骼健康管理方案。 骨质减少的严峻挑战 骨质减少症,作为骨质疏松症的前兆,给绝经后妇女带来了巨大的健康风险。在Osteoboost获批之前,患者只能依赖运动和饮食等生活方式干预,然而这些方法并未被证明能够显著减缓骨密度的损失。Osteo... 查看详情
20
1月
FDA授予Avutometinib/Sotorasib联合治疗KRAS突变的非小细胞肺癌
肺癌一直是全球范围内最常见的癌症之一,而KRAS突变型非小细胞肺癌(NSCLC)则占据其中的重要一部分。近期,美国食品药品监督管理局(FDA)加速通过了Avutometinib(VS-6766)与Sotorasib(Lumakras)联合应用,用于治疗未曾接受KRAS G12C抑制剂的KRAS G12C突变型NSCLC患者。 背景 KRAS突变在NSCLC中是一个常见但难以治疗的亚型,因此寻找有效的治疗方法一直是临床研究的重点。目前,FDA的快速通道认证为Avutometinib与Sotorasib联合治疗提供了更快速的审批通道,为KRAS G12C突变型NSCLC患者带来了新的治疗希望。 临... 查看详情
20
1月
KYV-101治疗难治性进行性多发性硬化症获FDA快速通道批准
在医学领域,细胞治疗技术的不断进步为那些患有自身免疫疾病的患者带来了新的曙光。针对难治性进行性多发性硬化症(MS)的治疗,Kyverna Therapeutics宣布其自体、完全人源CD19嵌合抗原受体(CAR)T细胞产品候选药物KYV-101获得了美国食品和药物管理局(FDA)的快速通道指定。这一消息意味着,KYV-101有望成为一种创新的治疗手段,能够改善那些患有严重自身免疫疾病的患者的生活。 快速通道指定:加速突破治疗瓶颈 获得FDA的快速通道指定是对Kyverna Therapeutics致力于开发新药以解决严重或危及生命病症的努力的认可。该计划旨在促进和加速新药的开发和审查,特别是针... 查看详情

-300x225.jpg)