20
1月
美国FDA授予Ianalumab治疗干燥综合征的突破性疗法认定
2026年1月6日,美国食品药品监督管理局(FDA)授予Ianalumab针对干燥综合征的突破性疗法认定。Ianalumab是一种研究中的全人源单克隆抗体药物,通过阻断B细胞活化因子受体,清除B细胞并抑制其存活与激活,从而作用于B细胞驱动的自身免疫性疾病。 该认定基于NEPTUNUS-1和NEPTUNUS-2这两项多中心III期临床试验的结果。这两项研究旨在评估与安慰剂相比,Ianalumab治疗从基线至第48周时患者欧洲抗风湿病联盟干燥综合征疾病活动指数(ESSDAI)的变化。 在2025年10月美国风湿病学会年会上公布的数据显示,在NEPTUNUS-1试验中,Ianalumab组ESSDA... 查看详情
19
1月
欧盟批准Aspaveli(pegcetacoplan)用于C3肾小球病和原发性免疫复合物膜增生性肾小球肾炎治疗
2026年1月16日,Aspaveli(pegcetacoplan)已获得欧洲委员会批准,用于治疗12岁及以上青少年及成年患者的C3肾小球病(C3G)或原发性免疫复合物膜增生性肾小球肾炎(IC-MPGN),通常需与肾素-血管紧张素系统抑制剂联合使用,除非患者无法耐受或存在禁忌。 欧洲约有8000人患有C3G或原发性IC-MPGN。Aspaveli是首个用于治疗原发性IC-MPGN的药物,也是首个适用于12岁及以上C3G和原发性IC-MPGN患者的治疗方法。 此项批准基于欧洲药品管理局人用药品委员会于2025年12月给出的积极意见。Aspaveli是一种靶向C3/C3b抑制剂,旨在调节过度的补体... 查看详情
19
1月
Tegoprazan治疗胃食管反流病已向美国FDA提交新药申请
2026年1月9日,Tegoprazan的新药申请已向美国食品药品监督管理局提交,申请用于治疗胃食管反流病。该申请寻求涵盖三个适应症:非糜烂性反流病、糜烂性食管炎的愈合治疗以及愈合后维持治疗。 若获得批准,Tegoprazan将成为首个在糜烂性食管炎治疗中,针对所有严重程度分级及所有观察时间点均显示优于质子泵抑制剂疗效的钾离子竞争性酸阻断剂类药物。 在非糜烂性反流病的治疗中,与安慰剂相比,Tegoprazan在改善胃食管反流病的标志性症状——24小时烧心、夜间烧心以及反流方面,均取得了具有临床意义的改善。 Tegoprazan在45分钟内即可实现快速的酸控制。 在所有研究中,Tegopraza... 查看详情
15
1月
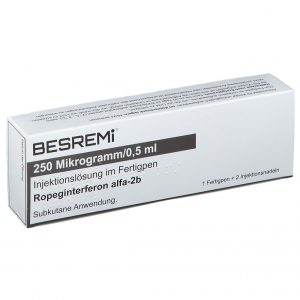
FDA受理Besremi(Ropeginterferon Alfa-2b)治疗原发性血小板增多症补充申请
美国食品药品监督管理局(FDA)受理了关于Besremi(Ropeginterferon Alfa-2b)用于治疗原发性血小板增多症的补充生物制品许可申请。该申请的目标审评截止日期为2026年8月30日。 此次递交的补充生物制品许可申请旨在寻求批准Ropeginterferon Alfa-2b-njft用于治疗成人原发性血小板增多症患者。原发性血小板增多症是一种罕见的血液肿瘤,过去二十多年来尚未有新的疗法获得批准。 支持此次申请的关键数据来自III期临床试验SURPASS-ET和IIb期临床试验EXCEED-ET。 在SURPASS-ET试验中,接受Besremi治疗的患者在12个月时达到持久... 查看详情
14
1月
美国FDA受理Oclaiz治疗肢端肥大症新药申请重新提交
2026年1月,美国食品药品监督管理局受理了用于治疗肢端肥大症的药物Oclaiz的新药申请重新提交。Oclaiz是一种长效奥曲肽制剂。根据《处方药使用者费用法案》,监管机构为此申请设定了2026年6月10日的目标审评日期。这一进展标志着该药物在美国的审批进程向前推进了一步。 肢端肥大症是一种罕见且常被漏诊的内分泌疾病,若未能得到有效控制可能导致严重的长期并发症。该疾病通常由垂体良性肿瘤引发,肿瘤过量分泌生长激素,进而刺激胰岛素样生长因子1水平升高,导致骨骼和软组织异常生长。常见症状包括手脚增大、面部特征改变、内脏器官增大,并可能伴随关节疼痛、疲劳、头痛、多汗、视力障碍及肢体麻木或刺痛。除了生理... 查看详情
14
1月
美国FDA批准Zycubo用于治疗儿童门克氏综合征(Menkes病)
2025年1月12日,FDA批准了Zycubo(copper histidinate,组氨酸铜注射液,Sentynl Therapeutics Inc公司生产)用于治疗儿童门克氏综合征(Menkes病)。此次批准标志着针对这种神经退行性疾病的首个治疗方案问世,该疾病患者三年以上生存率极低。 批准基于两项开放标签、单臂临床试验的结果,这些试验评估了接受Zycubo治疗患者的总体生存情况。治疗组共66名患者,其数据与17名未经治疗的对照组患者进行了比较。结果显示,治疗组的死亡风险降低了78%。 长期生存获益方面,试验观察到近半数接受治疗的患者生存期超过六年,而未经治疗对照组的六年生存率为0%。无论... 查看详情
13
1月
欧盟批准Teizeild(替利珠单抗)用于2期1型糖尿病治疗
欧盟委员会已批准赛诺菲公司Teizeild(teplizumab,替利珠单抗)用于延缓8岁及以上2期1型糖尿病成人及儿科患者向3期1型糖尿病的进展。此项批准基于欧洲药品管理局人用药品委员会给出的积极意见。 Teizeild(teplizumab,替利珠单抗)是欧盟首个获批用于治疗1型糖尿病的疾病修饰疗法,标志着这一进展性自身免疫疾病的治疗取得重要进展。此次批准基于TN-10二期研究的积极结果。该研究表明,在患有2期1型糖尿病的8岁及以上成人和儿童中,与安慰剂相比,Teizeild可将3期1型糖尿病的发病时间中位延迟两年。 在TN-10二期研究结束时,Teizeild组中仍处于2期1型糖尿病的患... 查看详情
13
1月
欧盟批准SPINRAZA(诺西那生钠)高剂量方案用于脊髓性肌萎缩症治疗
2026年01月12日,Biogen宣布欧洲委员会已授予SPINRAZA® (nusinersen,诺西那生钠)高剂量治疗方案的上市许可,该方案包含50毫克/5毫升和28毫克/5毫升两种剂量,用于治疗5q脊髓性肌萎缩症。5q脊髓性肌萎缩症是该疾病最常见的形式,约占所有病例的95%。欧盟对SPINRAZA的上市授权已更新,纳入了这一高剂量方案。 新的高剂量治疗方案采用更快速的负荷期给药方式:起始阶段为两次50毫克负荷剂量,间隔14天给药,随后每四个月给予一次28毫克的维持剂量注射。正在接受12毫克剂量治疗的患者若转为高剂量方案,将在下一次预定给药时接受一次50毫克剂量,随后每四个月接受28毫克维... 查看详情
09
1月
美国FDA授予Hyrnuo一线治疗HER2阳性非小细胞肺癌突破性疗法认定
美国食品药品监督管理局(FDA)已授予Sevabertinib(商品名Hyrnuo,曾用研发代号BAY 2927088)突破性疗法认定,用于一线治疗携带激活型HER2(ERBB2)突变的不可切除或转移性非小细胞肺癌患者。中国国家药品监督管理局药品审评中心也已针对相同适应症授予该药突破性治疗药物资格。 这些监管决定意味着,针对这一既往缺乏获批一线靶向疗法的肺癌分子亚型,治疗策略正转向以靶向干预为主的新模式。Hyrnuo是一种研究性的口服高选择性酪氨酸激酶抑制剂,旨在靶向HER2和EGFR突变,尤其对HER2外显子20插入突变和点突变具有特异性效力。 2025年11月,FDA已加速批准Hyrnuo... 查看详情
09
1月
英国上市舌下疗法Kynmobi(阿扑吗啡)用于间歇性治疗帕金森病
2026年01月07日,Bial公司在英国推出KYNMOBI®(盐酸阿扑吗啡,apomorphine hydrochloride)舌下薄膜剂,这是首个用于帕金森病患者间歇性治疗“关期”(“OFF”期)发作的舌下疗法。 据统计,英国约有16.6万人患有帕金森病,其中多数患者可能会在某个阶段经历“关期”期。这些发作通常发生在患者日常服用的左旋多巴等口服药物效果逐渐减弱时,导致运动症状如僵硬、震颤和活动困难再次出现,影响患者的日常活动、自主性和生活质量。在此背景下,作为常规抗帕金森药物的补充,按需使用的救援治疗显得尤为重要。这类疗法能快速、针对性地缓解症状,帮助改善患者的生活质量。 阿扑吗啡舌下制剂... 查看详情