29
12月
Bezuclastinib改善系统性肥大细胞增多症的骨髓异常
根据在2025年美国血液学会年会暨展览会上公布的2期SUMMIT试验数据,Bezuclastinib治疗使非进展性系统性肥大细胞增多症患者的关键骨髓病理学指标发生逆转。 研究结果显示,在基线时,接受Bezuclastinib治疗的可评估患者中有74%存在骨髓肥大细胞聚集,安慰剂组该比例为78%。至第24周,Bezuclastinib组的比例降至13%,而安慰剂组为60%。 基线时,Bezuclastinib组患者的平均骨髓肥大细胞水平为18%,安慰剂组为16%。第24周时,Bezuclastinib组降至5%,安慰剂组为14%。此外,基线时骨髓中平均纺锤形肥大细胞水平在Bezuclastini... 查看详情
26
12月
Veligrotug治疗甲状腺眼病获得美国FDA优先审评资格
近日,美国食品药品监督管理局(FDA)已受理Viridian生物技术公司的veligrotug用于治疗甲状腺眼病的生物制品许可申请。该申请被授予优先审评资格,处方药使用者费用法案目标审评日期定为2026年6月30日。 优先审评将生物制品许可申请的目标审评时间从受理后的十个月缩短至六个月。该资格授予那些若获批准有望在治疗严重疾病的安全性或有效性方面带来显著改善的药物申请。这是veligrotug在2025年获得的第二个FDA认定。2025年5月,该药物已获得突破性疗法认定。这两项认定的申请均包含了veligrotug在三期临床试验中的数据,证明其在慢性甲状腺眼病患者中能持续、显著地改善和消除复视... 查看详情
25
12月
美国FDA批准YARTEMLEA(Narsoplimab)用于造血干细胞移植相关血栓性微血管病治疗
2025年12月24日,Omeros公司宣布,美国食品药品监督管理局(FDA)已批准YARTEMLEA(narsoplimab-wuug)用于治疗造血干细胞移植相关血栓性微血管病。这是一种由补体凝集素途径激活驱动的、常危及生命的干细胞移植并发症。YARTEMLEA是首个且唯一获批的凝集素途径抑制剂。该药物可选择性抑制凝集素途径效应酶MASP-2,在阻断途径激活的同时,保留对宿主防御至关重要的经典和旁路补体功能。YARTEMLEA获批用于成人及两岁及以上儿童患者。 YARTEMLEA的获批基于一项针对成人TA-TMA患者的单臂开放标签研究结果,并得到扩展访问项目中额外数据的支持。疗效评估以TMA... 查看详情
25
12月
美国FDA批准AQVESME(mitapivat)用于α-或β-地中海贫血治疗
2025年12月23日,Agios制药公司今日宣布,美国食品药品监督管理局已批准口服丙酮酸激酶激活剂AQVESME™(mitapivat),用于治疗α-或β-地中海贫血成人患者的贫血。基于此项批准,AQVESME成为美国食品药品监督管理局批准的唯一一款同时适用于非输血依赖型和输血依赖型α-或β-地中海贫血患者贫血的治疗药物。 美国食品药品监督管理局对AQVESME用于地中海贫血的批准,基于全球随机、双盲、安慰剂对照的三期临床试验ENERGIZE和ENERGIZE-T的结果。这两项试验分别针对非输血依赖型和输血依赖型的α-或β-地中海贫血成人患者。共有452名能代表真实世界地中海贫血人群的患者参... 查看详情
24
12月
欧盟批准赛诺菲Wayrilz(Rilzabrutinib)治疗免疫性血小板减少症
2025年12月23日,欧盟委员会已批准Wayrilz(rilzabrutinib),一种新型口服可逆性布鲁顿酪氨酸激酶(BTK)抑制剂,用于治疗对其他疗法难治的成人免疫性血小板减少症(ITP)患者。该批准基于欧洲药品管理局人用药品委员会提出的积极意见。 Wayrilz通过多免疫调节靶向不同免疫通路,有助于针对ITP的根本病因。ITP是一种由复杂免疫失调导致的罕见疾病,表现为血小板计数降低、出血及生活质量下降。 欧盟批准基于关键性LUNA 3三期研究数据。该研究显示,Wayrilz在达到主要和次要终点方面优于安慰剂,对血小板计数的持续提升及其他ITP症状改善具有积极作用。 LUNA 3三期研究... 查看详情
24
12月
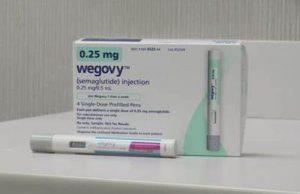
美国FDA批准口服减重药物Wegovy(司美格鲁肽片剂)用于成人肥胖症及心血管风险患者
在OASIS 4试验中,若所有患者坚持治疗,每日一次Wegovy®(semaglutide,司美格鲁肽)25毫克片剂平均减重约17%;无论患者是否坚持治疗,平均减重约14%。 起始剂量1.5毫克计划于2026年1月初上市,通过储蓄优惠计划月费用为149美元;该口服片剂在美国生产,备有充足供应。 Wegovy®是唯一经证实,在饮食和运动基础上,可用于降低确诊心血管疾病且伴有超重或肥胖的成人患者发生危及生命的心血管事件风险的GLP-1减重药物;在美国,约有320万人曾使用过Wegovy®。 2025年12月22日,美国食品药品监督管理局(FDA)批准每日一次给药的Wegovy®口服片剂,这是美国首... 查看详情
23
12月
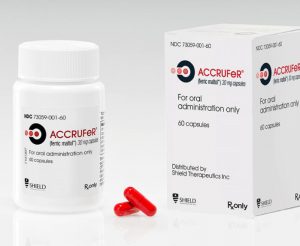
美国FDA批准铁剂Accrufer用于10岁及以上缺铁性贫血治疗
2025年12月22日,美国FDA已批准Accrufer(ferric maltol)用于治疗10岁及以上患者的缺铁症。该口服铁剂疗法现适用于10岁以上患有缺铁症的成人和青少年患者。 此次扩大适应症的批准基于优先审评,将Accrufer的使用范围从2019年首次获批的成人患者扩展至10岁及以上的儿科缺铁患者。这一决定反映了日益增长的临床证据,支持Accrufer在年轻缺铁及缺铁性贫血人群中的安全性和有效性。 缺铁是全球最常见的营养和血液疾病之一,可影响各年龄段患者。在儿科患者中,未经治疗的缺铁及缺铁性贫血可能导致疲劳、认知发育受损和身体耐力下降。口服铁剂仍是治疗的基石,但耐受性和依从性挑战限制... 查看详情
23
12月
美国FDA批准Fesilty用于先天性纤维蛋白原缺乏症急性出血治疗
2025年12月19日,Grifols公司宣布,美国FDA批准人纤维蛋白原浓缩剂Fesilty(fibrinogen,human-chmt),用于治疗伴有急性出血事件的先天性纤维蛋白原缺乏症(CFD)患者,包括低纤维蛋白原血症或无纤维蛋白原血症的儿科及成人患者。该药物计划于2026年上半年在美国上市。 先天性纤维蛋白原缺乏症是一种罕见的遗传性血液疾病,会导致凝血功能异常。纤维蛋白原是肝脏产生的关键凝血蛋白,CFD患者体内该蛋白的功能或数量存在缺陷。当缺陷基因仅来自父母一方时,患者可能出现纤维蛋白原水平降低,称为低纤维蛋白原血症;若缺陷基因来自父母双方,则导致纤维蛋白原完全缺乏,称为无纤维蛋白原... 查看详情
22
12月
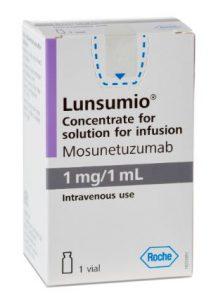
FDA批准Lunsumio VELO(mosunetuzumab-axgb)用于滤泡性淋巴瘤皮下注射治疗
FDA已批准基因泰克的CD20xCD3双特异性抗体Lunsumio VELO™(mosunetuzumab-axgb)皮下注射制剂,用于治疗既往接受过两线或以上系统治疗的复发或难治性滤泡性淋巴瘤成人患者。此项批准基于I/II期GO29781研究的结果,并以加速批准途径获得。该方案的完全批准可能取决于验证性试验中对获益的进一步确认。 与需要2至4小时静脉输注的给药方式相比,Lunsumio VELO的皮下注射给药时间缩短至约一分钟。与静脉给药的Lunsumio类似,Lunsumio VELO可在门诊使用,并且是固定疗程治疗,治疗周期可短至六个月。 此次批准主要依据GO29781研究在三级或更晚期... 查看详情
22
12月
美国FDA批准Myqorzo(Aficamten)治疗梗阻性肥厚型心肌病
2025年12月19日,美国食品药品监督管理局(FDA)批准Aficamten(商品名Myqorzo)用于治疗有症状的梗阻性肥厚型心肌病(oHCM)成人患者,以改善其功能能力和症状。该药提供5毫克、10毫克、15毫克和20毫克片剂规格。 此项批准基于第三期SEQUOIA-HCM临床试验的积极结果。该试验证实,Myqorzo在症状、运动能力、血流动力学及生物标志物终点等多个方面均显示出稳健的疗效、安全性和具有临床意义的获益。值得注意的是,Myqorzo的美国完整处方信息中含有一项关于心力衰竭风险的加框警告。 Myqorzo是一种心脏肌球蛋白马达活性的变构可逆抑制剂。在oHCM患者中,该药通过抑制... 查看详情