22
2月
日本批准ANDEMBRY(garadacimab)用于遗传性血管性水肿治疗
2025年2月20日,CSL Behring宣布,其创新药物ANDEMBRY®(garadacimab)已获得日本厚生劳动省的批准,用于预防遗传性血管性水肿(HAE)急性发作。这是全球首个通过预填充注射笔(200mg)进行每月一次皮下注射的治疗方案,标志着治疗HAE的一个重要突破。 ANDEMBRY®的创新机制:针对激活的第十二因子 ANDEMBRY®是一种全人单克隆抗体,专门用于抑制激活的第十二因子(FXIIa),这一因子在HAE的病理过程中起着关键作用。HAE是一种由免疫系统异常引发的疾病,导致血管扩张和水肿,通常发生在面部、腹部、喉部等部位。与传统的治疗方法不同,ANDEMBRY®直接在... 查看详情
21
2月
Epkinly(Epcoritamab)获日本批准用于治疗复发或难治性滤泡性淋巴瘤
2024年,日本厚生劳动省批准了Epkinly(Epcoritamab)用于治疗已接受过两种或更多治疗方案的复发或难治性1至3A级滤泡性淋巴瘤患者。这一批准为许多患有滤泡性淋巴瘤的患者提供了新的治疗选择,尤其是在治疗选择有限的情况下。Epkinly的批准基于多项临床研究的数据,特别是EPCORE NHL-1和EPCORE NHL-3临床试验的结果。 滤泡性淋巴瘤的治疗挑战与Epkinly的潜力 滤泡性淋巴瘤(FL)是一种常见的B细胞非霍奇金淋巴瘤,通常进展缓慢,但复发后治疗效果逐渐减弱。患者的治疗选择有限,尤其是在经历了两种或更多次治疗后。对于这些患者而言,缺乏有效的标准治疗方案,迫切需要创新... 查看详情
21
2月
Zongertinib获美国FDA优先审评用于HER2突变晚期非小细胞肺癌治疗
近日,Boehringer Ingelheim宣布,其研发的Zongertinib(BI 1810631)获得美国食品药品监督管理局(FDA)优先审评,用于治疗成人不可切除或转移性非小细胞肺癌(NSCLC)患者。该申请的批准基于一项积极的临床试验结果,Zongertinib若获批,将成为首个口服靶向治疗药物,用于治疗已有治疗史的HER2(ERBB2)突变晚期NSCLC患者。 Zongertinib:靶向HER2突变的创新治疗方案 HER2(ERBB2)突变晚期非小细胞肺癌患者目前面临着治疗选择的匮乏。传统的治疗方法对于这类患者疗效有限,因此,Zongertinib的研发被寄予厚望。Zonger... 查看详情
20
2月
Vatiquinone治疗Friedreich共济失调症获美国FDA优先审查
2024年,美国食品药品监督管理局(FDA)正式受理了PTC Therapeutics公司关于Vatiquinone的新药申请(NDA)。该药物作为一种潜在治疗Friedreich共济失调症(FA)的药物,预计将在2025年8月19日前作出决定。这一申请已获得优先审评资格,意味着FDA将加快对其的审查过程。 PTC Therapeutics的首席执行官Matthew B. Klein博士表示:“我们非常高兴地看到,Vatiquinone距离成为治疗Friedreich共济失调症患者的批准药物又迈出了重要一步。如果获批,Vatiquinone将成为第一个用于治疗儿童FA患者的疗法,同时为成人患者... 查看详情
20
2月
美国FDA批准基孔肯雅疫苗Vimkunya
2024年,FDA批准了Bavarian Nordic公司开发的Vimkunya疫苗,使其成为首个获得FDA批准用于12岁及以上患者的基孔肯雅病毒(Chikungunya)疫苗。这一批准标志着基孔肯雅病毒预防领域的重大突破,为全球范围内的公众健康保护提供了新的解决方案。 Vimkunya疫苗的临床试验数据 Vimkunya的获批基于两项大规模III期临床试验的强有力免疫原性数据。这两项试验共纳入了超过3500名参与者,数据显示,Vimkunya能够在21天内产生高达97.8%的中和抗体反应,且治疗后一周内即显现出快速的免疫应答,这一结果也正是研究的主要终点之一。此外,疫苗的耐受性良好,大多数与... 查看详情
20
2月
吉利德每年两次HIV预防疫苗Lenacapavir的新药申请获美国FDA优先受理
Gilead Sciences近期宣布,旗下药物Lenacapavir(商品名称:Sunlenca)已获得美国食品药品监督管理局(FDA)的受理,并将针对其作为HIV暴露前预防(PrEP)治疗的应用进行优先审评。这一进展意味着,如果获得批准,Lenacapavir将成为全球首个每年注射两次的HIV预防药物,极大拓展了HIV预防的治疗选择。 Lenacapavir的潜力与FDA优先审评 Lenacapavir的开发背景是基于其在HIV治疗中的潜力,尤其在多药物耐药性HIV患者中的应用。作为一种创新型药物,Lenacapavir是HIV-1衣壳抑制剂,其通过干扰HIV病毒生命周期中的多个阶段来抑制... 查看详情
19
2月
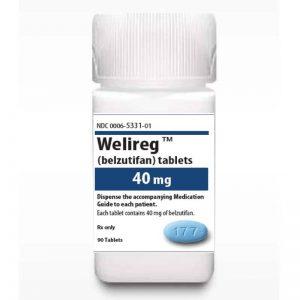
欧盟委员会批准Welireg(贝组替凡)治疗VHL病相关肿瘤和晚期透明细胞肾癌
2024年,欧盟委员会批准了贝组替凡(Belzutifan,Welireg)作为单药治疗,适用于特定的VHL(冯·希佩尔-林道病)相关肿瘤以及晚期透明细胞肾细胞癌(ccRCC)的成人患者。这一批准标志着贝组替凡成为治疗VHL病相关肾细胞癌、中央神经系统血管母细胞瘤(CNS hemangioblastomas)以及胰腺神经内分泌肿瘤(pNET)患者的首个系统性治疗药物,也为那些已经接受过PD-(L)1抑制剂以及至少两种VEGF靶向治疗的晚期透明细胞肾癌患者提供了新的治疗选择。 贝组替凡(Welireg)的适应症与批准背景 贝组替凡获得批准的适应症包括: 对于患有VHL病并且需要治疗的成人患者,适... 查看详情
18
2月
欧盟获批准Nemluvio(奈莫利珠单抗)用于治疗中度至重度特应性皮炎和结节性痒疹
近日,欧洲委员会正式批准了Galderma公司研发的Nemluvio®(Nemolizumab,奈莫利珠单抗)用于治疗中度至重度特应性皮炎(AD)和结节性痒疹(PN)。这一批准基于一系列临床研究结果,证明了Nemluvio在缓解这两种疾病症状方面的显著效果,尤其是对顽固性瘙痒、皮肤损伤以及睡眠障碍的改善。 Nemluvio的作用机制与创新性 Nemluvio是首个获批的靶向IL-31受体α的单克隆抗体。IL-31是一种神经免疫细胞因子,与瘙痒、炎症和皮肤屏障功能障碍密切相关。它在特应性皮炎和结节性痒疹的发生中发挥着重要作用,因此,抑制IL-31的信号传导可以有效缓解这些疾病的主要症状。Neml... 查看详情
18
2月
FDA批准Penmenvy疫苗用于预防侵袭性脑膜炎球菌疾病
2025年2月15日,英国伦敦——GSK公司宣布,美国食品药品监督管理局(FDA)已批准Penmenvy(脑膜炎球菌A、B、C、W和Y群疫苗)用于10至25岁人群的侵袭性脑膜炎球菌疾病(IMD)预防。这款疫苗针对的是导致脑膜炎球菌疾病的五个主要群体——A、B、C、W和Y群,这些群体通常是脑膜炎球菌引起的侵袭性疾病的罪魁祸首。 Penmenvy疫苗的组合成分与其临床研究背景 Penmenvy疫苗结合了GSK旗下两款成熟脑膜炎球菌疫苗的抗原成分:Bexsero(脑膜炎球菌B群疫苗)和Menveo(脑膜炎球菌A、C、Y和W-135群寡糖白喉CRM197结合疫苗)。这一结合成分使得Penmenvy能够... 查看详情
18
2月
美国FDA批准Romvimza(vimseltinib)用于治疗有症状的腱鞘巨细胞瘤
2025年2月14日,美国食品药品监督管理局(FDA)批准了vimseltinib(商品名:Romvimza,由Deciphera Pharmaceuticals研发)作为一种激酶抑制剂,用于治疗成年患者的有症状的腱鞘巨细胞瘤(TGCT)。此类患者的病情通常是由于手术切除可能导致功能限制加重或严重的并发症,从而难以进行常规手术治疗。 Romvimza(vimseltinib)的临床试验研究 Romvimza的疗效通过MOTION临床试验(NCT05059262)得到了评估。该试验是一项双盲、多中心、随机(2:1)对照、安慰剂对照的研究,旨在探讨TGCT患者在手术切除风险较高情况下使用vimse... 查看详情