05
12月
Zorevunersen治疗Dravet综合征获得FDA突破性疗法认定
Dravet综合症是一种严重的、遗传性癫痫病,通常在生命的第一年内发病,表现为频繁且持续的癫痫发作。这种疾病难以治疗,患者常常面临着长期的健康问题和生活质量的严重下降。随着目前治疗手段的局限性,患者及其家庭迫切需要新的疗法来有效应对这一挑战。近日,Stoke Therapeutics公司宣布其研发中的药物Zorevunersen获得了美国FDA的突破性治疗药物认定(Breakthrough Therapy Designation)。这一批准为Dravet综合症的治疗带来了新的希望,同时也意味着Zorevunersen可能成为首个疾病修饰性药物。 Zorevunersen:一种潜在的疾病修饰性药... 查看详情
05
12月
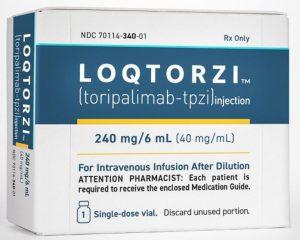
特瑞普利单抗(Loqtorzi)联合化疗被纳入更新版NCCN指南作为先进鼻咽癌首选一线治疗
头颈癌,尤其是鼻咽癌(NPC),一直是全球范围内的主要癌症类型之一。在鼻咽癌的治疗中,患者的预后与肿瘤的分期、治疗方案的选择密切相关。近年来,随着免疫治疗的快速发展,尤其是免疫检查点抑制剂的出现,头颈癌的治疗进入了一个新的时代。特瑞普利单抗(Loqtorzi)作为一种PD-1抑制剂,已经在多个国家的临床试验中展现出其优异的疗效,特别是在复发性、不可切除、寡转移或转移性鼻咽癌的治疗中。 2025年版的《美国国家综合癌症网络(NCCN)头颈癌指南》对特瑞普利单抗(toripalimab-tpzi ,Loqtorzi)的推荐进行了重要更新,确立了其作为鼻咽癌一线治疗的首选方案。 特瑞普利单抗(Loq... 查看详情
05
12月
FDA加速批准Bizengri(Zenocutuzumab)用于治疗NRG1+非小细胞肺癌和胰腺癌
随着精准医学和分子靶向治疗的发展,癌症治疗领域迎来了前所未有的突破。尤其是在治疗某些罕见的癌症亚型时,靶向治疗成为了越来越多患者的希望。近期,美国食品药品监督管理局(FDA)批准了Bizengri(Zenocutuzumab-zbco)用于治疗NRG1基因融合阳性的非小细胞肺癌(NSCLC)和胰腺腺癌,这一批准为患者提供了一种新的治疗选择。 NRG1基因融合与癌症的关系 NRG1基因融合是一种较为罕见的分子改变,通常出现在非小细胞肺癌和胰腺腺癌等癌症中。NRG1(Neuregulin 1)是一种编码细胞信号传导的蛋白质,其基因融合会导致异常的细胞信号传导,从而促进肿瘤的生长和扩散。由于其突变的... 查看详情
05
12月
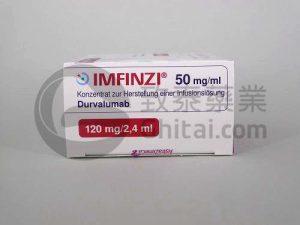
FDA批准Imfinzi(durvalumab,度伐单抗)用于局限期小细胞肺癌治疗
小细胞肺癌(SCLC)是一种高度恶性且进展迅速的肺癌类型,其主要分为局限期(limited stage)和广泛期(extensive stage)两种。局限期小细胞肺癌的治疗通常依赖于同步化疗和放疗,但即使如此,患者的生存期和治愈率依然不理想。近年来,免疫治疗在肿瘤治疗中的应用取得了突破性进展,特别是在小细胞肺癌领域。最近,美国食品药品监督管理局(FDA)批准了Imfinzi(durvalumab,度伐单抗)用于治疗局限期小细胞肺癌(LS-SCLC)患者,特别是那些在同步铂类化疗和放疗后未发生疾病进展的患者。 Imfinzi(durvalumab,度伐单抗)在局限期小细胞肺癌治疗中的应用 Im... 查看详情
05
12月
Ersodetug治疗肿瘤高胰岛素血症引发的低血糖症获FDA孤儿药认证
在罕见疾病的治疗领域,尤其是对于与癌症相关的低血糖症,新的治疗手段的需求日益迫切。肿瘤引发的高胰岛素血症(Tumor Hyperinsulinism,HI)是导致低血糖的一个重要原因,然而,现有治疗方案的效果有限,患者面临着严重的健康风险。近期,Rezolute公司宣布,其研发的药物Ersodetug(RZ358)获得了美国食品药品监督管理局(FDA)颁发的孤儿药认定(Orphan Drug Designation,ODD),这一认证不仅标志着对这一药物潜力的肯定,也为解决肿瘤高胰岛素血症引发的低血糖问题带来了新的希望。 Ersodetug获FDA孤儿药认证,迎接罕见疾病治疗的新契机 FDA赋... 查看详情
04
12月
IMCIVREE(setmelanotide)在英国获批用于2岁及以上儿童遗传性肥胖症与控制饥饿
近年来,遗传性肥胖症和食欲亢进症状成为全球医学界关注的焦点之一。尤其是那些由基因突变引起的稀有疾病,如Bardet-Biedl综合征(BBS)以及由POMC、PCSK1和LEPR基因缺陷导致的肥胖症,这些疾病给患者的生活质量带来了严重影响。随着基因治疗和个性化医疗的不断进展,一些新药逐渐被批准用于治疗这些特殊病症,IMCIVREE(setmelanotide)便是其中的重要一员。近日,IMCIVREE在英国的适应症范围得到了扩展,能够为更广泛的患者群体提供帮助,尤其是年龄较小的儿童。 IMCIVREE的扩展适应症:覆盖更广泛的患者群体 2024年12月3日,Rhythm Pharmaceuti... 查看详情
04
12月
Aficamten治疗梗阻性肥厚型心肌病的新药申请获FDA受理
心脏肥厚型心肌病(Hypertrophic Cardiomyopathy,HCM)是一种常见的遗传性心血管疾病,影响着大量患者。此病以心肌厚度异常增大为特点,导致心脏功能受限,进而出现运动耐力下降、胸痛、呼吸急促等症状。对于患有梗阻性肥厚型心肌病(oHCM)的患者,治疗选择一直较为有限,尤其是在传统药物治疗效果不理想的情况下。然而,随着新型药物的出现,治疗梗阻性肥厚型心肌病的前景正发生显著变化。近日,Cytokinetics公司宣布,其开发的心脏肌动蛋白抑制剂Aficamten的NDA(新药申请)已获得美国食品药品监督管理局(FDA)的接受,这一进展标志着梗阻性肥厚型心肌病治疗进入新的阶段。 ... 查看详情
04
12月
乌司奴单抗生物仿制药Yesintek治疗多种免疫疾病获FDA批准
随着生物制药行业的不断发展,越来越多的生物仿制药开始走上市场,作为原研药的有力替代品,不仅能为患者提供更多的治疗选择,还能有效降低治疗成本。近期,印度生物制药公司Biocon Biologics研发的Yesintek(Ustekinumab-kfce,司奴单抗)获得了美国食品药品监督管理局(FDA)的批准,成为第六款参照原研药Stelara(乌司奴单抗)的生物仿制药。该药物将用于治疗包括银屑病关节炎、炎症性肠病(IBD)在内的多种免疫系统相关疾病。这一批准不仅是Biocon Biologics的重要里程碑,也是生物仿制药在全球市场进一步发展的标志。 Yesintek的批准背景 Yesintek... 查看详情
03
12月
全液态脑膜炎球菌疫苗Menveo获得欧盟委员会批准
脑膜炎球菌性疾病(IMD)是一种由脑膜炎球菌引起的严重传染病,虽然这种疾病相对罕见,但一旦发生往往会迅速引发严重后果,包括脑膜炎、败血症等,甚至可能导致长期的神经损伤、截肢和听力丧失等不可逆损害。对于这些高风险人群,及时接种疫苗成为预防脑膜炎球菌感染的重要手段。近期,全球制药公司GSK(葛兰素史克)推出的全液态脑膜炎球菌疫苗Menveo获得了欧盟委员会(EC)的批准,旨在为2岁及以上的人群提供更便捷的免疫保护。 疫苗新形式的批准与简化接种流程 此次获批的全液态版本Menveo疫苗采用单瓶包装,设计上旨在简化疫苗的接种过程。与传统需要混合溶液的粉末型疫苗不同,新的液态疫苗可以直接使用,无需接种前... 查看详情
03
12月
FDA批准Cobenfy用于成年人精神分裂症
精神分裂症(schizophrenia)是一种复杂的精神障碍,其症状多样且常常影响患者的日常生活。尽管现代药物治疗已取得显著进展,但该病依然没有一种药物能完全解决其广泛的症状和个体差异。近年来,精神分裂症的治疗方法并未出现革命性的突破。然而,近期美国食品药品监督管理局(FDA)批准了一种全新的药物——Cobenfy(由xanomeline和trospium chloride组成)。这一新药的批准不仅代表着治疗精神分裂症的新方向,也标志着几十年来药物治疗领域的一次重大突破。 Cobenfy:一种全新的药物类别 Cobenfy的批准为精神分裂症的治疗带来了新的希望。它属于一种新类别的药物,即mus... 查看详情