23
8月
FDA受理Imcivree(setmelanotide)用于继发性下丘脑性肥胖症的补充新药申请
美国食品药品监督管理局(FDA)已受理Rhythm Pharmaceuticals公司就Imcivree(setmelanotide)提交的补充新药申请(sNDA),用于治疗与继发性下丘脑性肥胖相关的患者。该申请获得优先审评资格,并设定了2025年12月20日为处方药用户费用法案(PDUFA)目标日期。 药品机制与疾病背景 继发性下丘脑性肥胖是一种罕见肥胖类型,由下丘脑物理损伤或结构异常引起。下丘脑是大脑中负责能量平衡、自主神经系统调节、昼夜节律和控制垂体激素的区域,其损伤可能源于脑肿瘤切除手术、头部创伤、感染、放射或脑出血。MC4R通路负责控制能量消耗、饥饿感和体重调节等功能,该通路受损会导... 查看详情
22
8月
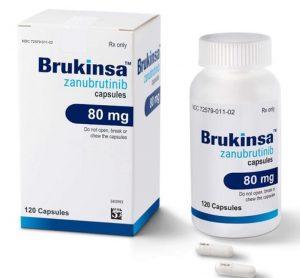
欧盟批准BRUKINSA(泽布替尼片剂)用于所有已获批适应症
欧盟委员会已批准全球肿瘤学企业BeOne Medicines Ltd.(百济)的新型薄膜包衣片剂配方BRUKINSA®(zanubrutinib,泽布替尼)用于所有已获批适应症。 剂型优势与患者便利 新开发的BRUKINSA片剂旨在满足患者的实际需求,可简化治疗过程、减轻服药负担并提升给药便利性。该片剂每片剂量为160毫克,推荐日服总剂量仍为320毫克。患者每日服药数量因此从四粒胶囊减少至两片药片。片剂体积较胶囊更小,并采用薄膜包衣技术,更易于吞咽。 BRUKINSA的临床特点 BRUKINSA是一种口服小分子布鲁顿酪氨酸激酶(BTK)抑制剂,通过优化生物利用度、半衰期和选择性,实现对BTK蛋... 查看详情
22
8月
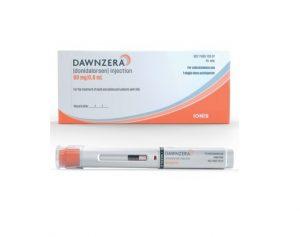
Dawnzera(Donidalorsen)获美国FDA批准用于预防遗传性血管性水肿发作
美国食品药品监督管理局(FDA)近日批准了Ionis Pharmaceuticals公司的Dawnzera™ (donidalorsen),这是一种用于预防12岁及以上成人和儿科患者遗传性血管性水肿(HAE)发作的RNA靶向疗法。该批准为美国约7000名受这种罕见且可能危及生命的遗传性疾病困扰的患者提供了一种新的治疗选择。 药品特性 Dawnzera是首个且目前唯一获批用于HAE的RNA靶向药物,其作用靶点为血浆前激肽释放酶(PKK)。PKK是一种关键蛋白,参与激活导致急性HAE发作的炎症介质。该药品通过皮下自动注射器进行自我给药,提供每四周一次或每八周一次的给药方案,是目前HAE预防治疗中最... 查看详情
21
8月
欧盟批准Ogsiveo(Nirogacestat)用于硬纤维瘤治疗
硬纤维瘤,又称侵袭性纤维瘤病,是一种罕见且具有局部侵袭性的软组织肿瘤。尽管不具备转移能力,但其侵袭性生长常导致严重疼痛、功能障碍及身体形态改变,对患者生活质量造成显著影响。长期以来,欧洲范围内缺乏获批的系统性治疗方案,临床管理依赖手术、放疗或非适应症使用的细胞毒性药物,治疗效果有限且伴随较大风险。2025年8月18日,欧洲委员会(EC)正式批准Ogsiveo(nirogacestat)作为单药治疗需要系统性治疗的进展性硬纤维瘤成人患者,标志着该疾病领域迎来了首个靶向口服疗法,为患者提供了新的治疗选择。 药品基本信息与作用机制 Ogsiveo (nirogacestat) 是一种选择性γ-分泌酶... 查看详情
20
8月
欧盟批准Rezdiffra(Resmetirom)治疗肝纤维化非肝硬化代谢功能障碍相关脂肪性肝炎
2025年08月19日,Madrigal Pharmaceuticals公司宣布,其药品Rezdiffra (resmetirom) 已获得欧盟委员会有条件批准,用于治疗患有中重度肝纤维化的非肝硬化代谢功能障碍相关脂肪性肝炎(MASH)成人患者。此次获批标志着Rezdiffra成为欧盟批准的首款MASH疗法。 药品基本信息 Rezdiffra (resmetirom) 是一款“first-in-class”的每日一次口服甲状腺激素受体(THR)-β选择性激动剂。该药物旨在靶向MASH的关键基础病因,通过高选择性激活肝细胞中的THR-β受体,在肝功能中发挥核心作用,影响血清胆固醇和甘油三酯水平,... 查看详情
19
8月
Ifinatamab Deruxtecan获FDA突破性疗法认定用于广泛期小细胞肺癌治疗
在肿瘤治疗领域,抗体药物偶联物(ADC)的研发为多种难治性癌症患者带来了新的希望。近期,美国食品药品监督管理局(FDA)授予ifinatamab deruxtecan(I-DXd)突破性疗法认定(BTD),用于治疗既往接受含铂化疗后疾病进展的广泛期小细胞肺癌(ES-SCLC)成人患者。这一认定基于II期IDeate-Lung01试验的积极数据,标志着该药物在解决ES-SCLC未满足的临床需求方面迈出了重要一步。 药物基本信息 Ifinatamab deruxtecan是一种靶向B7-H3的抗体药物偶联物。B7-H3是一种在多种癌症中过度表达的蛋白,包括小细胞肺癌,其过度表达与不良预后相关。目前... 查看详情
18
8月
FDA批准Papzimeos用于复发性呼吸道乳头状瘤病治疗
2025年8月15日,Precigen公司宣布美国食品药品监督管理局(FDA)已完全批准Papzimeos™(zopapogene imadenovec-drba)用于治疗成人复发性呼吸道乳头状瘤病(RRP)。这一里程碑式的批准标志着RRP患者群体迎来了首个且唯一获FDA批准的疗法,为这一罕见且具有潜在生命威胁的疾病提供了全新的治疗选择。Papzimeos的获批不仅填补了临床治疗的空白,也为患者带来了从根源上干预疾病进展的希望。 复发性呼吸道乳头状瘤病(RRP)的疾病背景 复发性呼吸道乳头状瘤病(RRP)是一种罕见、慢性且可能危及生命的疾病,由人乳头瘤病毒(HPV)6型或11型的持续感染引起。... 查看详情
18
8月
FDA批准Tonmya(Cyclobenzaprine)用于纤维肌痛症治疗
纤维肌痛症是一种以广泛性肌肉骨骼疼痛、疲劳和睡眠障碍为特征的慢性疾病,长期以来缺乏创新疗法。2025年,美国食品药品监督管理局(FDA)批准了Tonix Pharmaceuticals公司研发的Tonmya(盐酸环苯扎林舌下片),这是十五年来首个针对纤维肌痛症的新型治疗方案。作为一种非阿片类镇痛药,Tonmya通过独特的舌下给药方式和中枢作用机制,为患者提供了疼痛缓解和睡眠质量改善的双重获益。 药物基本信息 Tonmya是一种舌下给药的环苯扎林(cyclobenzaprine, CBP)制剂,其化学名称为盐酸环苯扎林(cyclobenzaprine HCl)。该药物最初开发代号为TNX-102... 查看详情
16
8月
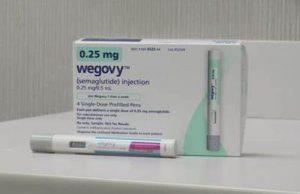
FDA批准Wegovy(司美格鲁肽)用于代谢功能障碍相关脂肪性肝炎治疗
2025年8月15日,美国食品药品监督管理局(FDA)批准了Wegovy®(semaglutide,司美格鲁肽)2.4 mg注射液的新适应症,用于治疗伴有中晚期肝纤维化(F2至F3期)但未进展至肝硬化的代谢功能障碍相关脂肪性肝炎(MASH)成人患者。该药物需在医生指导下,结合低热量饮食和增加体力活动使用。 药品基本信息 Wegovy®(司美格鲁肽)是一种每周一次的皮下注射药物。其2.4 mg剂量此次获批用于治疗MASH伴中晚期肝纤维化患者。 除新适应症外,Wegovy®此前已获FDA批准用于: 降低已知心脏病合并超重或肥胖成人患者的主要心血管事件风险 辅助12岁及以上肥胖儿童和成人的长期体重管... 查看详情
14
8月
FDA批准Brinsupri(brensocatib)作为首款非囊性纤维化支气管扩张症的药物
2025年8月12日,美国食品药品监督管理局(FDA)批准了Brinsupri™(brensocatib 10毫克和25毫克片剂),用于治疗成人和12岁及以上儿童的非囊性纤维化支气管扩张(NCFB)。Brinsupri是首个且唯一获得FDA批准的NCFB治疗药物,为美国数十万患者和临床医生提供了一种管理这一慢性进展性肺部疾病的新选择。 疾病背景 非囊性纤维化支气管扩张是一种严重的慢性肺部疾病,其特征是气道永久性扩张,导致黏液和细菌清除困难,进而引发持续性炎症和感染。该疾病的典型表现为频繁急性加重,症状包括咳嗽、痰量增多、呼吸困难和疲劳。据估计,美国约有50万NCFB患者,全球范围内患病人数可能... 查看详情