12
8月
美国FDA优先审评gepotidacin口服治疗单纯性泌尿生殖系统淋病
淋病是一种由淋病奈瑟菌引起的性传播感染,近年来其发病率持续攀升,且耐药性问题日益严峻。美国食品药品监督管理局(FDA)近期受理了gepotidacin(吉泊达星)用于治疗单纯性泌尿生殖系统淋病的补充新药申请,并授予优先审评资格,这为淋病的治疗提供了潜在的新选择。 药品基本信息 gepotidacin是一种全球首创的三氮杂苊类抗生素,由葛兰素史克公司研发。该药物通过双重抑制细菌的II型拓扑异构酶,阻断DNA复制,从而发挥抗菌作用。其对淋病奈瑟菌及其他尿路病原体(包括耐药菌株)均表现出良好的活性。 适应症与目标人群 此次申请针对的是12岁及以上(体重≥45公斤)患者的单纯性泌尿生殖系统淋病。若获批... 查看详情
11
8月
FDA受理Vepdegestrant治疗ESR1突变ER阳性/HER2阴性乳腺癌的新药申请
乳腺癌是全球女性最常见的恶性肿瘤之一,其中雌激素受体(ER)阳性/HER2阴性亚型约占所有乳腺癌病例的70%。对于这类患者,内分泌治疗是主要的治疗手段,但部分患者会出现ESR1基因突变,导致对传统内分泌治疗产生耐药性。近年来,新型选择性口服PROTAC ER降解剂vepdegestrant的研发为这一患者群体带来了新的希望。 Vepdegestrant的新药申请进展 美国食品药品监督管理局(FDA)已受理vepdegestrant的新药申请(NDA),用于治疗既往接受过内分泌治疗的ER阳性/HER2阴性、ESR1突变晚期或转移性乳腺癌患者。根据《处方药用户费用法案》(PDUFA),FDA的目标... 查看详情
09
8月
Epkinly(epcoritamab)组合在滤泡性淋巴瘤3期试验中显示疗效优势并获FDA优先审评资格
Epcoritamab(商品名Epkinly)联合利妥昔单抗(Rituxan)和来那度胺治疗复发/难治性滤泡性淋巴瘤成人患者的3期EPCORE FL-1研究(NCT05409066)达到双重主要终点。该方案在客观缓解率(ORR)和无进展生存期(PFS)方面显示出统计学显著且具有临床意义的改善。 2025年7月24日,美国FDA接受了Epkinly(epcoritamab)联合利妥昔单抗和来那度胺用于至少接受过一线系统治疗的复发/难治性滤泡性淋巴瘤的补充生物制品许可申请(sBLA),并授予优先审评资格。FDA设定的目标审评截止日期为2025年11月30日。若获批,该方案将成为美国首个可用于滤泡性... 查看详情
09
8月
FDA加速批准Hernexeos(Zongertinib,宗格替尼)用于HER2突变非鳞状非小细胞肺癌治疗
2025年08月08日,美国食品药品监督管理局(FDA)通过加速审批途径批准了宗格替尼Zongertinib(商品名Hernexeos)用于治疗携带HER2酪氨酸激酶结构域(TKD)激活突变且既往接受过系统治疗的不可切除或转移性非鳞状非小细胞肺癌(NSCLC)患者。这一决定基于该药物在临床试验中展现出的显著疗效和可接受的安全性特征。同时,FDA还批准了Oncomine Dx Target Test作为伴随诊断检测工具,用于识别HER2 TKD激活突变。 药物特性与作用机制 宗格替尼(Hernexeos)是一种新型酪氨酸激酶抑制剂(TKI),其独特之处在于能够选择性地、不可逆地抑制HER2,而不... 查看详情
08
8月
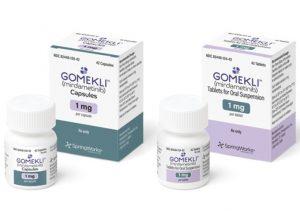
Gomekli(mirdametinib)降低了NF1相关丛状神经纤维瘤患者的治疗障碍
2025年2月,美国食品药品监督管理局(FDA)正式批准mirdametinib(商品名:Gomekli)用于治疗2岁及以上神经纤维瘤病1型(NF1)相关症状性丛状神经纤维瘤(PNs)患者。这一批准标志着Gomekli成为首个且目前唯一获批用于成人和儿童NF1相关PNs患者的药物。Emory大学医学院儿科教授Timothy Gershon博士指出,这一批准将显著改善成人患者的治疗可及性,消除了超说明书用药带来的诸多障碍。 药品基本信息 Gomekli是一种MEK抑制剂,通过抑制MAPK/ERK信号通路发挥作用。该通路在NF1相关肿瘤的生长中起关键作用。NF1基因突变导致Ras信号通路持续激活,... 查看详情
08
8月
Ajovy(Fremanezumab)获FDA批准用于儿童及青少年偏头痛预防
偏头痛是一种常见的神经系统疾病,不仅困扰成年人,也影响着儿童和青少年的生活质量。近期,美国食品药品监督管理局(FDA)批准Ajovy(fremanezumab)用于6岁及以上、体重不低于45公斤的儿童及青少年偏头痛预防,成为首款针对该人群的CGRP靶向预防药物。 药品基本信息 Ajovy是一种人工合成的单克隆抗体药物,通过靶向抑制降钙素基因相关肽(CGRP)发挥作用。CGRP是一种与偏头痛发作密切相关的蛋白质。该药物于2018年首次获批用于成人偏头痛预防,此次扩展适应症为儿童及青少年患者提供了新的治疗选择。 数据显示,约5%的5至10岁儿童和15%的青少年受偏头痛困扰,症状包括剧烈头痛、恶心、... 查看详情
08
8月
FDA批准Modeyso(dordaviprone)用于复发性H3 K27M突变弥漫性中线胶质瘤治疗
2025年8月6日,爵士制药公司宣布,美国食品药品监督管理局(FDA)已加速批准Modeyso™(dordaviprone)用于治疗1岁及以上复发性H3 K27M突变弥漫中线胶质瘤(diffuse midline glioma, DMG)患者。该疾病是一种罕见且高度侵袭性的脑肿瘤,此前缺乏有效的系统性治疗方案。此次批准标志着神经肿瘤学领域的重要突破,为患者及其家庭提供了首个FDA批准的靶向治疗选择。 Modeyso™的临床意义与背景 H3 K27M突变弥漫中线胶质瘤是一种主要影响儿童和年轻成人的恶性脑肿瘤,其特点是疾病进展迅速,预后极差。据统计,美国每年约有2,000例新发病例,其中许多患者在... 查看详情
05
8月
FDA授予liso-cel(Breyanzi)用于复发/难治性边缘区淋巴瘤优先审评资格
美国食品药品监督管理局(FDA)已授予liso-cel(lisocabtagene maraleucel;商品名Breyanzi)补充生物制品许可申请(sBLA)优先审评资格,用于治疗接受过至少两种系统性治疗的复发/难治性边缘区淋巴瘤(MZL)成人患者。 药品疗效数据 liso-cel在复发/难治性MZL患者中显示出显著的疗效。根据2期TRANSCEND FL试验(NCT04245839)MZL队列的数据,66例可评估疗效患者的总体缓解率(ORR)为95.5%(95% CI,87.3%-99.1%),其中完全缓解率(CR)为62.1%(95% CI,49.3%-73.8%)。 在随访中位数为2... 查看详情
05
8月
美国FDA批准Inclisiran(Leqvio)单药疗法用于高胆固醇血症治疗
高胆固醇血症是心血管疾病的重要危险因素,低密度脂蛋白胆固醇(LDL-C)的持续升高与动脉粥样硬化性心血管疾病(ASCVD)的发生发展密切相关。近年来,靶向PCSK9的降脂药物为胆固醇管理提供了新的治疗选择。2025年7月,美国食品药品监督管理局(FDA)批准了inclisiran(商品名Leqvio)的标签更新,使其成为首个可作为单药治疗高胆固醇血症的PCSK9靶向疗法。 药物基本信息 Inclisiran是一种需要处方的小干扰RNA(siRNA)药物,通过靶向肝脏中的PCSK9 mRNA来降低其蛋白表达。PCSK9蛋白会加速LDL受体的降解,而抑制PCSK9可增加LDL受体数量,从而增强肝脏... 查看详情
03
8月
阿西米尼布Scemblix获加拿大批准用于费城染色体阳性慢性髓性白血病治疗
慢性髓性白血病(CML)是一种骨髓造血干细胞异常增殖的恶性肿瘤,其中费城染色体(Ph)阳性患者占绝大多数。近年来,酪氨酸激酶抑制剂(TKI)的应用显著改善了CML患者的预后,但部分患者仍面临耐药或不耐受的问题。2024年,新型靶向药物阿西米尼布Asciminib(商品名Scemblix)获得加拿大卫生部批准,用于初治及经治Ph+慢性期CML(CP-CML)成人患者的治疗。 药物概述 阿西米尼布Scemblix是一种特异性靶向BCR-ABL1蛋白肉豆蔻酰口袋(STAMP)的抑制剂,其作用机制与传统的ATP竞争性TKI不同。通过直接结合BCR-ABL1蛋白的肉豆蔻酰口袋,Scemblix能够抑制A... 查看详情