17
4月
FDA批准Isturia(Osilodrostat,奥唑司他)治疗内源性皮质醇增多症的库欣综合征患者
2025年4月16日,Recordati公司宣布美国食品药品监督管理局(FDA)批准奥唑司他Osilodrostat(ISTURISA)扩大适应症,用于治疗无法接受手术或手术未治愈的内源性皮质醇增多症的成年库欣综合征患者。这一决定基于奥唑司他临床开发项目的积极结果,标志着该药物在治疗库欣综合征方面的重要进展。 药物基本信息 奥唑司他(Osilodrostat)是一种皮质醇合成抑制剂,通过抑制11β-羟化酶发挥作用。11β-羟化酶是肾上腺皮质醇生物合成最后一步的关键酶。该药物最初于2020年3月获得FDA批准,用于治疗无法接受垂体手术或手术后仍患病的库欣病成人患者。 此次扩大适应症后,奥唑司他可... 查看详情
17
4月
FDA批准Maralixibat(Livmarli)片剂治疗Alagille综合征、进行性家族性肝内胆汁淤积症
2025年4月,美国食品药品监督管理局(FDA)批准了迈芮倍maralixibat(商品名Livmarli,氯马昔巴特)的新片剂剂型,用于治疗Alagille综合征(ALGS)和进行性家族性肝内胆汁淤积症(PFIC)患者的胆汁淤积性瘙痒。这一批准为患者和医生提供了更灵活的治疗选择,尤其是为年龄较大的患者带来了便利。 药品基本信息 Maralixibat是一种口服的肠道胆汁酸转运蛋白(IBAT)抑制剂,通过抑制胆汁酸在肠道的重吸收,减少胆汁酸在肝脏中的积累,从而缓解胆汁淤积性瘙痒等症状。该药物最初于2021年9月获得FDA批准,用于治疗1岁及以上ALGS患者的胆汁淤积性瘙痒,成为首个获批用于AL... 查看详情
16
4月
欧盟批准LEQEMBI(lecanemab,仑卡奈单抗)治疗早期阿尔茨海默病
阿尔茨海默病(Alzheimer’s Disease, AD)是一种渐进性神经退行性疾病,严重影响患者的认知功能和生活质量。随着全球人口老龄化加剧,AD的发病率逐年上升,给患者、家庭及社会带来沉重负担。长期以来,AD的治疗主要集中于缓解症状,而缺乏针对疾病根本机制的疗法。2025年4月15日,欧洲委员会(European Commission, EC)批准了Leqembi® (lecanemab,仑卡奈单抗) 的上市许可,标志着欧盟首次迎来一种能够延缓早期AD疾病进展的靶向治疗药物。 药物基本信息 Leqembi® (lecanemab,仑卡奈单抗) 是一种靶向β-淀粉样蛋白(Aβ)的单克隆抗... 查看详情
16
4月
FDA将审查Anktiva(Nogapendekin Alfa)治疗膀胱癌和淋巴细胞减少症
近年来,免疫疗法在肿瘤治疗领域取得了显著进展,其中 Nogapendekin Alfa(商品名:Anktiva) 作为一种新型免疫调节剂,在非肌层浸润性膀胱癌(NMIBC)及癌症相关淋巴细胞减少症的治疗中展现出重要潜力。近期,ImmunityBio 公司向美国食品药品监督管理局(FDA)提交了补充生物制品许可申请(sBLA)及扩大使用计划(EAP),旨在进一步拓展该药物的适应症范围。 Anktiva 的作用机制与现有适应症 Anktiva 是一种重组人白细胞介素-15(IL-15)超级激动剂复合物,通过激活自然杀伤(NK)细胞和记忆性T细胞,增强机体的抗肿瘤免疫反应。其独特的设计使其在体内具有... 查看详情
15
4月
欧盟批准罗氏Columvi(格菲妥单抗)治疗不适合移植的弥漫性大B细胞淋巴瘤
弥漫性大B细胞淋巴瘤(DLBCL)是一种侵袭性强、进展风险高的恶性肿瘤,许多患者在初始治疗后仍面临复发或疾病难治的困境。2025年4月14日,欧盟委员会批准罗氏(Roche)的Columvi®(glofitamab,格菲妥单抗)联合吉西他滨和奥沙利铂(GemOx)用于治疗不适合自体干细胞移植(ASCT)的复发或难治性(R/R)DLBCL成人患者。这一批准标志着Columvi成为欧洲首个可用于DLBCL早期复发或难治患者的双特异性抗体治疗方案,为这一高危群体提供了重要的治疗选择。 Columvi(glofitamab,格菲妥单抗)的临床意义 Columvi是一种CD20xCD3双特异性抗体,其独... 查看详情
11
4月
FDA批准贝伐单抗生物仿制药Jobevne用于多种实体瘤治疗
美国食品药品监督管理局(FDA)近期批准了bevacizumab生物仿制药Jobevne(bevacizumab-nwgd,贝伐单抗)用于治疗多种实体瘤适应症。该药物作为贝伐珠单抗(Avastin)的生物仿制药,将为患者提供更多治疗选择。 药物基本信息 Jobevne是一种重组人源化单克隆抗体,其作用机制与参照药贝伐珠单抗相同。该药物通过抑制血管内皮生长因子(VEGF)的活性,阻断肿瘤血管生成,从而抑制肿瘤生长和扩散。 获批适应症 Jobevne获FDA批准用于以下实体瘤的治疗: 转移性结直肠癌(mCRC):联合氟尿嘧啶类化疗用于一线或二线治疗;对于一线含贝伐珠单抗方案治疗后进展的患者,可联合... 查看详情
11
4月
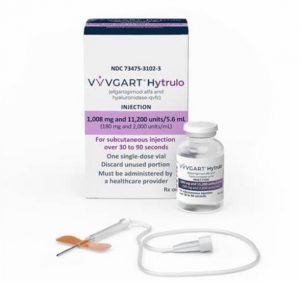
FDA批准VYVGART Hytrulo(艾加莫德预充式皮下注射剂)用于全身型重症肌无力和慢性炎性脱髓鞘性多发性神经根神经病的自我注射
近日,全球免疫学公司argenx SE宣布,美国食品药品监督管理局(FDA)已批准VYVGART® Hytrulo(efgartigimod alfa and hyaluronidase-qvfc,艾加莫德预充式皮下注射剂)用于自我注射,适用于抗乙酰胆碱受体(AChR)抗体阳性的全身型重症肌无力(gMG)成人患者及慢性炎性脱髓鞘性多发性神经根神经病(CIDP)成人患者。这一批准为患者提供了更灵活的治疗选择,使其能够在医生办公室、家中或旅行时自行注射药物,从而提升治疗的便利性和独立性。 VYVGART Hytrulo预充式注射器的特点与优势 VYVGART Hytrulo预充式注射器是一种皮下注... 查看详情
11
4月
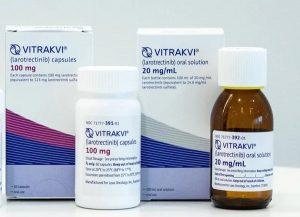
美国FDA完全批准VITRAKVI(拉罗替尼)用于NTRK基因融合阳性实体瘤治疗
2025年4月10日,拜耳公司宣布美国食品药品监督管理局(FDA)已完全批准VITRAKVI®(larotrectinib,拉罗替尼)用于治疗成人和儿童NTRK基因融合阳性的实体瘤患者。这一决定基于多项临床试验数据,证实VITRAKVI在多种NTRK融合阳性肿瘤中展现出持久的临床应答。此次完全批准标志着该药物在精准肿瘤治疗领域的重要地位,为缺乏有效治疗选择的患者提供了新的标准治疗方案。 VITRAKVI(拉罗替尼)的适应症与作用机制 VITRAKVI是一种首创(first-in-class)的口服TRK抑制剂,专门设计用于抑制TRK家族蛋白(TRKA、TRKB和TRKC)。该药物适用于成人和儿... 查看详情
10
4月
Ziftomenib治疗NPM1突变型复发/难治性急性髓系白血病向FDA提交新药申请
急性髓系白血病(AML)是一种恶性血液系统疾病,其中NPM1基因突变约占成人AML病例的30%。对于复发/难治性(R/R)NPM1突变型AML患者,目前尚无FDA批准的靶向治疗方案。近期,Kura Oncology公司向FDA提交了ziftomenib的新药申请(NDA),这一进展可能为这类患者带来新的治疗希望。 药物背景与作用机制 Ziftomenib是一种每日一次的口服menin抑制剂,靶向作用于menin-KMT2A/MLL蛋白复合物,这一复合物在NPM1突变型AML的发病机制中起关键作用。通过抑制menin与KMT2A的相互作用,ziftomenib可阻断白血病细胞的增殖信号通路,从而... 查看详情
10
4月
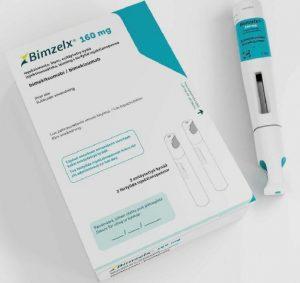
英国批准BIMZELX(bimekizumab,比奇珠单抗)用于中度至重度化脓性汗腺炎
化脓性汗腺炎是一种长期困扰患者的慢性炎症性皮肤病,其症状包括疼痛性结节、脓肿和排脓性瘘管,常发于腋窝、腹股沟和臀部等部位。这种疾病对患者的生活质量造成严重影响,不仅带来剧烈疼痛,还可能导致反复发作。近日,英国苏格兰药品联盟(Scottish Medicines Consortium,SMC)批准了BIMZELXBIMZELX(bimekizumab,比奇珠单抗)用于治疗中重度活动性化脓性汗腺炎成人患者,这为那些对传统系统疗法反应不佳的患者提供了新的治疗选择。 苏格兰成为英国首个批准BIMZELX的地区 苏格兰药品联盟的这项决定使得苏格兰成为英国首个为化脓性汗腺炎患者提供BIMZELX的地区。这... 查看详情