17
9月
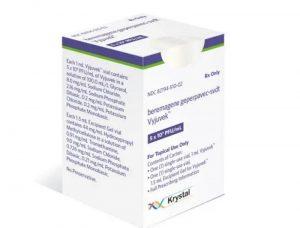
美国FDA批准VYJUVEK扩大DEB治疗适用范围至新生儿群体并允许居家给药
美国食品药品监督管理局(FDA)批准基因治疗药物Vyjuvek(beremagene geperpavec-svdt)的标签更新,用于治疗营养不良性大疱性表皮松解症(DEB)。此次更新将适用人群扩展至新生儿患者,并允许患者在家中自行用药。 Krystal Biotech公司宣布,经FDA批准的标签更新内容主要包括两方面:一是将治疗对象范围扩大至从出生起即患有DEB的患者;二是赋予患者用药和伤口敷料管理的完全灵活性。根据该公司2025年9月15日发布的声明,此次更新不仅允许DEB患者及其护理人员在家中自行使用Vyjuvek,还提供了更灵活的伤口敷料管理方案——患者无需等待24小时,即可在下次换药... 查看详情
16
9月
FDA授予CDH6靶向药物R-DXd(Raludotatug deruxtecan)治疗卵巢癌的突破性疗法称号
美国食品药品监督管理局(FDA)近日授予抗体偶联药物Raludotatug deruxtecan(R-DXd)突破性疗法认定,用于治疗表达CDH6的铂类耐药上皮性卵巢癌、原发性腹膜癌或输卵管癌成人患者,这些患者既往曾接受过贝伐珠单抗(安维汀)治疗。 R-DXd(Raludotatug deruxtecan)是一种潜在的首创CDH6靶向抗体偶联药物(ADC)。FDA的此项决定基于一项针对晚期卵巢肿瘤患者的R-DXd 1期研究(NCT04707248)的疗效与安全性数据,以及正在进行的评估该ADC药物治疗铂类耐药高级别卵巢癌、原发性腹膜癌或输卵管癌患者的2/3期REJOICE-Ovarian01试... 查看详情
16
9月
日本受理基因疗法Adstiladrin(Nadofaragene Firadenovec)用于非肌层浸润性膀胱癌的上市申请
日本厚生劳动省下属药品医疗器械综合机构(PMDA)已正式受理基因疗法nadofaragene firadenovec的新药上市申请,用于治疗卡介苗(BCG)无应答的非肌层浸润性膀胱癌(NMIBC)。这一决定为面临治疗困境的患者带来了新的希望。 该申请主要基于一项在日本开展的III期临床研究数据。研究结果显示,在接受单次季度给药的日本高危BCG无应答型NMIBC患者(伴有原位癌,伴或不伴高级别Ta或T1乳头状病变)中,3个月时的完全缓解率(CR)达到75%(n=20)。在安全性评估人群(n=16)中,80%的患者报告了治疗相关不良事件(AEs,n=76),其中84.2%为1级事件,15.8%为2... 查看详情
13
9月
日本上市辉瑞ベルスピティ(伊曲莫德)用于中重度溃疡性结肠炎
近日,辉瑞株式会社宣布,旗下用于治疗中等症至重症溃疡性结肠炎的药物 ——“ベルスピティ ® 片剂 2mg”(通用名:伊曲莫德 L-精氨酸)正式上市。该药物属于鞘氨醇 1 – 磷酸受体(S1P)调节剂,为这一疾病领域的患者带来了新的治疗希望。 尽管近年来溃疡性结肠炎的治疗药物选择有所增加,但仍有大量患者面临治疗困境:部分患者无法获得理想的治疗效果,还有不少患者出现二次无效、病情反复复发的情况。据日本厚生劳动省研究团队的数据显示,50% 的溃疡性结肠炎患者临床病程呈现复发缓解型特点;而欧洲一项社区人群队列研究也指出,患者 10 年间的累积复发率高达 67%。 在难治性病例治疗方面,虽然... 查看详情
12
9月
FDA受理NASP用于难治性痛风治疗的生物制剂许可申请
近日,美国食品药品监督管理局(FDA)已正式受理Sobi公司针对难治性痛风患者研发的创新疗法Nanoencapsulated Sirolimus plus Pegadricase(NASP,曾用名SEL-212)的生物制剂许可申请(BLA)。该申请基于NASP的临床研究数据,FDA已将其处方药用户费用法案(PDUFA)目标审批日期定为2026年6月27日。 关于难治性痛风 痛风是最常见的炎症性关节炎类型,美国有超过830万人被诊断患病。其病因是体内尿酸水平过高,导致尿酸盐在关节及其他组织中积聚,引发剧烈疼痛的急性发作。美国约有20万难治性痛风患者,尽管接受口服降尿酸治疗,血清尿酸(sUA)水平... 查看详情
11
9月
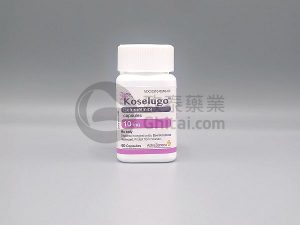
美国FDA批准司美替尼(Koselugo)用于1岁及以上伴有PN的1型神经纤维瘤病患者
美国食品药品监督管理局(FDA)近日批准司美替尼(Selumetinib,商品名:Koselugo)用于治疗1岁及以上伴有症状性、无法手术的丛状神经纤维瘤(PN)的1型神经纤维瘤病(NF1)儿科患者。该批准标志着该药物适用人群的进一步扩大——早在2020年4月,司美替尼胶囊剂已获准用于2岁及以上同类适应症的患者。 此次扩展批准基于一项健康成人中的相对生物利用度研究,证实口服颗粒剂与已获批胶囊制剂之间存在足够的桥接关系;同时,通过暴露量匹配分析, SPRINT二期临床试验第一层组(NCT01362803,针对2岁及以上患者使用胶囊制剂)与SPRINKLE研究(NCT05309668,针对1岁及以... 查看详情
11
9月
美国FDA接受Relacorilant治疗铂类耐药卵巢癌的新药上市申请
美国食品药品监督管理局(FDA)已正式受理Relacorilant联合白蛋白紫杉醇用于治疗铂类耐药卵巢癌患者的新药申请(NDA)。该申请主要基于关键性Ⅲ期临床试验ROSELLA(研究编号NCT05257408)及早期Ⅱ期研究的数据结果。这一进展为目前治疗选择有限的患者群体提供了新的潜在治疗方向。 申请方Corcept Therapeutics公司首席执行官Joseph Belanoff博士表示:“FDA受理我们的新药申请意味着我们向罹患这一严重疾病的患者提供急需治疗方案的目标更近了一步。Relacorilant有望重新定义铂耐药卵巢癌的治疗标准。” ROSELLA是一项随机Ⅲ期研究,入组对象为... 查看详情
11
9月
美国FDA批准INLEXZO(吉西他滨膀胱内给药系统)用于非肌层浸润性膀胱癌
近日,美国食品药品监督管理局(FDA)批准了一种新型膀胱癌治疗药物INLEXZO™(吉西他滨膀胱内给药系统),为非肌层浸润性膀胱癌患者提供了新的治疗选择。 INLEXZO™是首个也是唯一一个能够在膀胱内提供延长局部给药的药物释放系统(iDRS)。该药物专为BCG治疗无效且不适合或拒绝接受膀胱切除术的非肌层浸润性膀胱癌患者设计。每个治疗周期中,INLEXZO™可在膀胱内留置三周,最多可进行14个周期治疗。该系统的放置过程简便,在门诊环境中仅需几分钟即可完成,无需全身麻醉,放置后也无需在医疗机构内进行额外监测。 非肌层浸润性膀胱癌(NMIBC)是一种膀胱癌类型,可根据肿瘤大小、多发性肿瘤和原位癌(... 查看详情
11
9月
Emrusolmin获美国FDA快速通道认定用于治疗多系统萎缩症
近日,Teva Pharmaceuticals宣布其用于治疗多系统萎缩症(Multiple System Atrophy,MSA)的研究性药物emrusolmin(TEV-56286)已获得美国食品药品监督管理局(FDA)的快速通道认定。该药物目前处于二期临床试验阶段,旨在评估其疗效与安全性。 关于多系统萎缩症(MSA) 多系统萎缩症是一种罕见的神经退行性疾病,临床分类为“非典型帕金森综合征”,属于突触核蛋白病的范畴。该疾病的病理特征主要表现为α-突触核蛋白的异常沉积,主要存在于少突胶质细胞中,也可出现在部分神经细胞中。患者通常表现为自主神经系统功能障碍,如膀胱功能异常、勃起功能障碍、肠道蠕动... 查看详情
10
9月
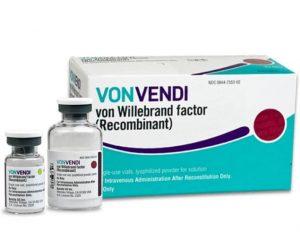
VONVENDI获美国FDA批准扩大适应症用于成人和儿童血管性血友病治疗
近日,美国食品药品监督管理局(FDA)批准扩大VONVENDI®[von Willebrand factor (Recombinant)]的适应症,涵盖更广泛的血管性血友病(VWD)患者群体。这一决定进一步拓展了该药物在成人和儿童患者中的应用范围。有临床专家指出,此次批准将常规预防确立为所有类型成人血管性血友病的标准护理方式,有助于降低出血风险并减轻患者日常生活中的负担。 血管性血友病是最常见的出血性疾病,仅在美国就有超过300万人受影响。该疾病因患者体内VWF蛋白水平偏低或功能异常而导致凝血功能障碍,可能引发危及生命的出血事件,严重影响患者生活质量。 适应症扩展内容 VONVENDI现获准用... 查看详情