09
12月
Omisirge(Omidubicel-onlv)获FDA批准用于治疗重型再生障碍性贫血
2025年12月8日,Omisirge(Omidubicel-onlv)获得美国食品药品监督管理局(FDA)批准,用于治疗重型再生障碍性贫血(SAA),这也是首款获批用于该病症治疗的造血干细胞移植(HSCT)疗法。此次获批属于Omisirge的补充性FDA批准,此前其已于2023年获FDA批准用于血液系统恶性肿瘤治疗,如今适用人群进一步拓展,涵盖接受降低强度预处理、且无法找到匹配供体的6岁及以上SAA成人和儿科患者。 Omisirge的此次获批基于一项正在进行的开放标签、单中心研究数据,该研究结果显示出极具鼓舞性的疗效表现。在疗效人群中,14名患者中有12名实现了早期且持续的中性粒细胞植入,中... 查看详情
09
12月
Imdelltra(塔拉妥单抗)用于复发难治小细胞肺癌的疗效数据及用法指南
面对铂类化疗后仍出现进展的广泛期小细胞肺癌(ES-SCLC),临床上长期缺乏高效、持久的治疗手段,患者预后极不理想。2024年5月,一种名为Imdelltra(通用名:tarlatamab-dlle,塔拉妥单抗)的创新药物获得了美国食品药品监督管理局(FDA)的加速批准,为这一困境带来了实质性的改变。随后,基于更充分的III期临床研究证据,该药物于2025年11月获得了FDA的完全批准,进一步确立了其在经治ES-SCLC治疗中的地位。 Imdelltra是一种双特异性T细胞衔接器(BiTE),代表着肿瘤免疫治疗领域的新进展。它并非直接杀伤癌细胞,而是巧妙地扮演了“免疫导航”的角色。其独特之处在... 查看详情
09
12月
脱细胞神经异体移植物Avance获批用于周围神经损伤修复
2025年12月3日,AVANCE®(脱细胞神经同种异体移植物,arwx)的生物制品许可申请获美国食品药品监督管理局(FDA)批准。该产品为脱细胞神经支架,适用于治疗成人及1个月及以上儿科患者的感觉神经、混合神经及运动神经断裂病症。 其中,针对缺损长度大于25毫米的感觉神经断裂,以及混合神经与运动神经断裂的适应症,是通过FDA的加速批准通道获批的。获批依据源于其在缺损长度≤25毫米的感觉神经间隙中对静态两点辨别觉的改善效果——基于病理生理学的相似性及预期治疗效果的一致性,该效果为合理预测临床获益提供了实证依据。不过,上述适应症的持续批准仍取决于后续验证性研究中对临床获益的验证与说明。 获批后,... 查看详情
07
12月
Rusfertide在治疗真性红细胞增多症方面持续显示出强劲效果
根据在2025年美国血液学会年会上公布的3期VERIFY研究最新数据,铁调素模拟肽药物Rusfertide在为期52周的治疗中,持续帮助真性红细胞增多症患者将血细胞比容控制在45%以下,并显著降低放血治疗需求。 在VERIFY研究的第一阶段,患者被随机分配接受Rusfertide联合标准治疗或安慰剂联合标准治疗,持续32周。标准治疗定义为联合或不联合细胞减灭治疗的放血疗法。32周后,安慰剂组患者交叉接受Rusfertide治疗,进入开放标签的延伸研究阶段,直至第52周。 研究结果显示,在初始的32周治疗期内,接受Rusfertide治疗的患者中有76.9%无需进行放血治疗,而安慰剂组这一比例为... 查看详情
07
12月
美国FDA批准Breyanzi用于复发或难治性边缘区淋巴瘤治疗
2025年12月04日,美国食品药品监督管理局批准了Breyanzi(Lisocabtagene maraleucel,liso-cel)的新适应症,使其成为美国首个用于治疗既往接受过两线或以上系统治疗后复发或难治性边缘区淋巴瘤成年患者的嵌合抗原受体T细胞疗法。Breyanzi是一种通过基因工程改造患者自身T细胞,使其能够靶向并杀伤癌细胞的CAR-T细胞疗法。 边缘区淋巴瘤是一种罕见的惰性淋巴系统肿瘤,约占所有B细胞非霍奇金淋巴瘤病例的7%,美国每年新增病例约7460例。对于初始治疗后复发或难治的边缘区淋巴瘤患者,其生存期往往缩短。 该批准基于一项开放标签、多中心、单臂临床试验,评估了Brey... 查看详情
05
12月
FDA授予Zilganersen用于治疗亚历山大病的突破性疗法认定
Ionis Pharmaceuticals公司用于治疗亚历山大病(AxD)的研究性药物Zilganersen获得了美国食品药品监督管理局授予的突破性疗法认定,这对其神经疾病研发管线是一个重要进展。这种罕见且破坏性极强的神经系统疾病目前尚无获批的疾病修正疗法,因此FDA的决定是应对这一长期未满足医疗需求的重要一步。 亚历山大病是一种累及儿童和成人的进行性神经退行性疾病。其特征是异常蛋白质在中枢神经系统积累,导致严重的症状,包括行动能力丧失、行走、说话、吞咽困难,在疾病晚期还会出现呼吸功能受损。许多患者病情迅速恶化,该疾病常常致命。鉴于疾病的严重性以及有效治疗方案的缺乏,突破性疗法认定旨在为那些展... 查看详情
04
12月
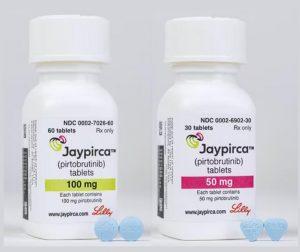
FDA批准Jaypirca(匹妥布替尼)用于复发/难治性慢性淋巴细胞白血病或小淋巴细胞淋巴瘤治疗
Jaypirca(Pirtobrutinib,匹妥布替尼)获美国食品药品监督管理局(FDA)批准,用于治疗既往接受过共价布鲁顿酪氨酸激酶(BTK)抑制剂治疗的复发或难治性慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者,该获批结论基于Ⅲ期BRUIN CLL-321试验的研究结果。试验数据显示,Jaypirca(匹妥布替尼)治疗组的中位无进展生存期(PFS)为11.2个月,而替代治疗组的中位无进展生存期为8.7个月,风险比(HR)为0.58,具有统计学意义。FDA已为既往接受过共价BTK抑制剂治疗的复发或难治性CLL或SLL患者群体,授予Jaypirca(匹妥布替尼)传统批准资格,适... 查看详情
04
12月
baxdrostat用于难治性高血压的新药申请获美国FDA优先审评
2025年12月2日,阿斯利康宣布baxdrostat针对难治性高血压患者的新药申请(NDA)已获美国食品药品监督管理局(FDA)受理,并纳入优先审评程序。该药物适用于成人难治性(未控制或治疗抵抗性)高血压患者,作为其他抗高血压药物的附加治疗手段,尤其适用于当这些药物无法充分降低血压时的临床场景。 借助优先审评凭证,该申请的《处方药用户收费法案》(PDUFA)目标审评日期预计为2026年第二季度。此次新药申请的提交,基于BaxHTN III期临床试验的积极结果——该试验证实,baxdrostat能为抵抗性或未控制高血压患者带来具有统计学显著性和临床意义的收缩压降低效果。若最终获得批准,baxd... 查看详情
03
12月
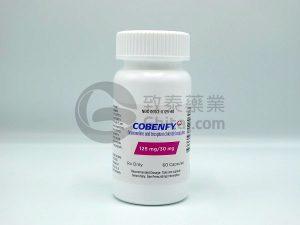
Cobenfy(Xanomeline/Trospium)治疗精神分裂症的疗效与安全性评估
精神分裂症是一种复杂的严重慢性精神疾病,全球约有2400万人受其困扰。患者常经历幻觉、妄想、思维混乱以及社会功能退缩等症状,这些症状严重损害个人的社会与职业功能,给家庭和社会带来沉重负担。数十年来,精神分裂症的药物治疗主要依赖于阻断大脑中的多巴胺通路。虽然这类药物能有效控制部分症状,但常常伴随令人困扰的副作用,如体重显著增加、代谢紊乱、嗜睡以及锥体外系症状(如静坐不能、肌肉僵硬等),导致许多患者难以坚持治疗。 2024年9月,美国食品药品监督管理局(FDA)批准了一种名为Cobenfy(xanomeline-trospium chloride)的新药,用于治疗成人精神分裂症。这标志着五十多年来... 查看详情
03
12月
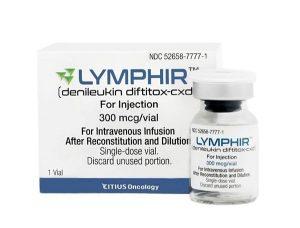
Lymphir(denileukin diftitox)在美国上市用于皮肤T细胞淋巴瘤治疗
LYMPHIR™(denileukin diftitox,地尼白介素)已正式在美国开启商业化上市进程。作为一款新型IL-2受体导向融合蛋白,该药物已获得美国食品药品监督管理局(FDA)批准,适用于接受过至少一种全身性治疗后,复发或难治性(r/r)Ⅰ-Ⅲ期皮肤T细胞淋巴瘤(CTCL)成年患者的治疗。 FDA对LYMPHIR的批准基于关键302研究(NCT01871727)的数据,该研究评估了LYMPHIR在接受过至少一种全身性治疗的Ⅰ-Ⅲ期CTCL患者中的疗效与安全性。研究结果显示,该药物的客观缓解率(ORR)达到36.2%,84%的可评估患者皮肤肿瘤负荷出现降低。此外,LYMPHIR对CTCL... 查看详情